Kemičar u kući (#31): Oprez, oksalna kiselina!
U serijalu „Kemičar u kući“ objavljujemo kemijske zanimljivosti iz svakodnevnog života. Želimo vam pokazati kako znanje kemije može svakome, pa i ne-kemičaru, pomoći u svakodnevnom životu.
Živio nekoć neki njemački krojač koji je redovito pio, da bi potakao rad svojih lijenih crijeva, gorku sol (magnezijev sulfat) pa poslao šegrta u obližnju ljekarnu da mu je kupi. Dječak je stao u red, kad, eto, čuje kupca ispred njega da spominje „Klesalz“. No od riječi Klesalz čuo je samo „Salz“, (sol), a kako je i on trebao kupiti nakakav „Salz“ (Bittersalz), reče kratko ljekarniku: „Dajte i meni isto!“
Rezultat: dječakov je majstor umjesto jedne „soli“ popio drugu, naime umjesto gorke soli popio je oksalnu kiselinu i nedugo potom umro. Ljekarnik je pak završio na sudu, jer je izdao lijek mimo svakog propisa. Prvo, djeci se ne smiju izdavati otrovi, a drugo, svakog pacijenta ljekarnik treba pitati što mu treba i za što mu treba. (Oksalna kiselina služi za skidanje hrđe.) Neki mi se znanac tuži da mu u ljekarni nisu htjeli izdati glicerin (glicerol) kada je rekao da mu treba za mazanje automobilskih guma. Ispravno i logično: ljekarnik nije automehaničar da zna hoće li glicerol pneumaticima štetiti ili koristiti.
Ova poučna priča koju sam pronašao u knjizi za farmaceute govori budućim ljekarnicima što im se može dogoditi ako se ne pridržavaju ravno 55 naputaka o tome što ljekarnik treba i što ne treba (ne smije) činiti – jer ljudski su životi u pitanju!
Kako god čitali ovu poučnu priču (ili horror story) jasno je da je oksalna kiselina otrov. No, kakav otrov? U nekoj knjizi o toksikologiji čitam: „Oksalana kiselina je jako otrovna. Najmanja zabilježena količina koja je dovela do smrtonosnog trovanja je 2 g, a bilo je slučajeva ozdravljenja i poslje uzimanja količine od 45 g.“ I što sad na to reći?
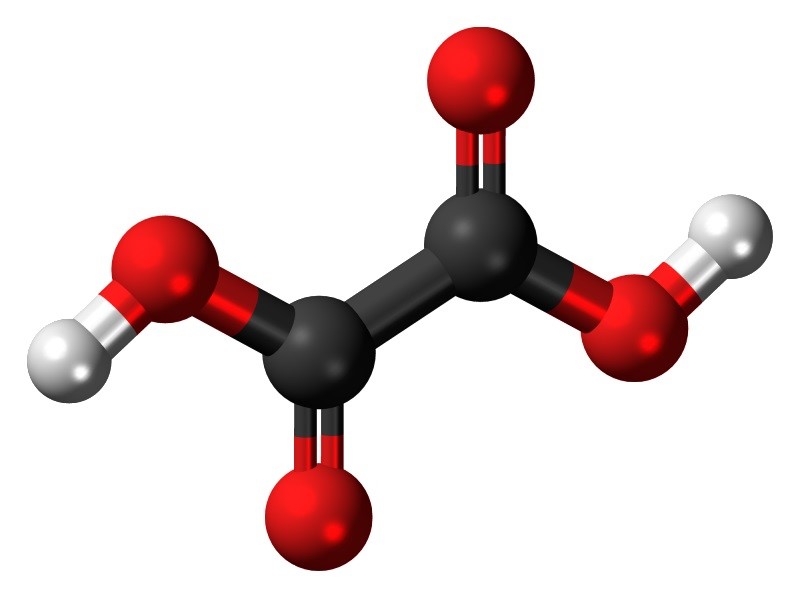
Oksalna je kiselina najjednostavnija dvovalentna organska kiselina, jer se sastoji od samo dvije karboksilne skupine, bez ikakvog atoma među njima. Njezina je formula HOOC-COOH, s time da kristalizira s dvije molekule vode, dakle (COOH)2⸱2H2O. U tom se vidu pojavljuje u obliku prozirnih kristala koji se tale na 102 oC. Anhidrat se pak tali na 187 oC, a može i sublimirati ako se polako zagrijava. No to su već detalji koji zanimaju kemičara. Ono što bi pak trebalo zanimati svakoga je kako izbjeći sudbinu krojača kojem je šegrt donio oksalnu kiselinu umjesto gorke soli.

Riječ je o tome da se s oksalnom kiselinom svaki dan susrećemo, a da toga nismo svijesni. Jedna naranča sadrži 20 miligrama oksalne kiseline, šalica tekuće čokolade 65 mg; u 100 grama kikirikija ima pak 100 mg oksalne kiseline. No najviše oksalne kiseline ima u špinatu i rabarbati – u 100 g špinata ima 645, a u istoj masi rabarbare čak 887 mg oksalne kiseline!
No, tu je zamka. Kako je moguće da jednog čovjeka ubiju dva grama oksalne kiseline, a drugome nije dosta ni dvadeset puta veća doza – čak 45 grama? Riječ je o tome da se oksalna kiselina rijetko nalazi u slobodnom stanju (kao u slučaju nesretnog krojača). Ona se poglavito nalazi u obliku svojih soli, oksalata.
Neki su oksalati topljivi u vodi, drugi nisu. Topljive su soli kalija i natrija, no slabo su topljive soli magnezija, a posebice kalcija. A ono što nije topljivo u vodi (niti u želučanoj kiselini) nije otrovno. Barij je jako otrovan, 2 do 10 grama barijeva klorida dovoljno je da ubije čovjeka, no ne i barijev sulfat – koji se (čak!) uzima kao kontrastno sredstvo („kreda“) za rendgensko snimanje želuca. Takav je slučaj i s oksalnom kiselinom, točnije s njezinim solima koje se se nalaze u hrani.

Sve u svemu, ne treba se oksalata bojati, ali ih ipak treba izbjegavati, posebice ako čovjek pati od bubrežnih kamenaca, od kojih većina (70 %) nastaje od oksalata. Stoga se oksalati u hrani ne smatraju otrovima nego samo antinutrijentima. Ne bi ih se trebalo uzimati više od 50 – 100 mg dnevno.
I još nešto: kad jedete špirnat, priređujte ga obavezno s mliječnim umakom (bešamelom). U mlijeku ima naime kalcija koji će neutralizirati oksalnu kiselinu.

Nenad Raos, rođen 1951. u Zagrebu, je kemičar, doktor prirodnih znanosti i znanstveni savjetnik, sada u mirovini. Još od studentskih dana bavi se popularizacijom znanosti. Autor je više stručnih i 13 znanstveno-popularnih knjiga, među njima i knjige „Deset kemijskih pokusa koji su promijenili svijet“ koja je izišla 2000. godine kao prošireni katalog istoimene izložbe u zagrebačkom Tehničkom muzeju Nikola Tesla. Urednik je rubrike „Kemija u nastavi“ u časopisu Kemija u industriji, za koji piše i redovite komentare. Nagrađen je Državnom godišnjom nagradom za promidžbu i popularizaciju znanosti 2003. godine.