Kako se retrovirusi "ukopavaju" u našu DNK... i kako ih pokušavamo "iskopati" CRISPR-om
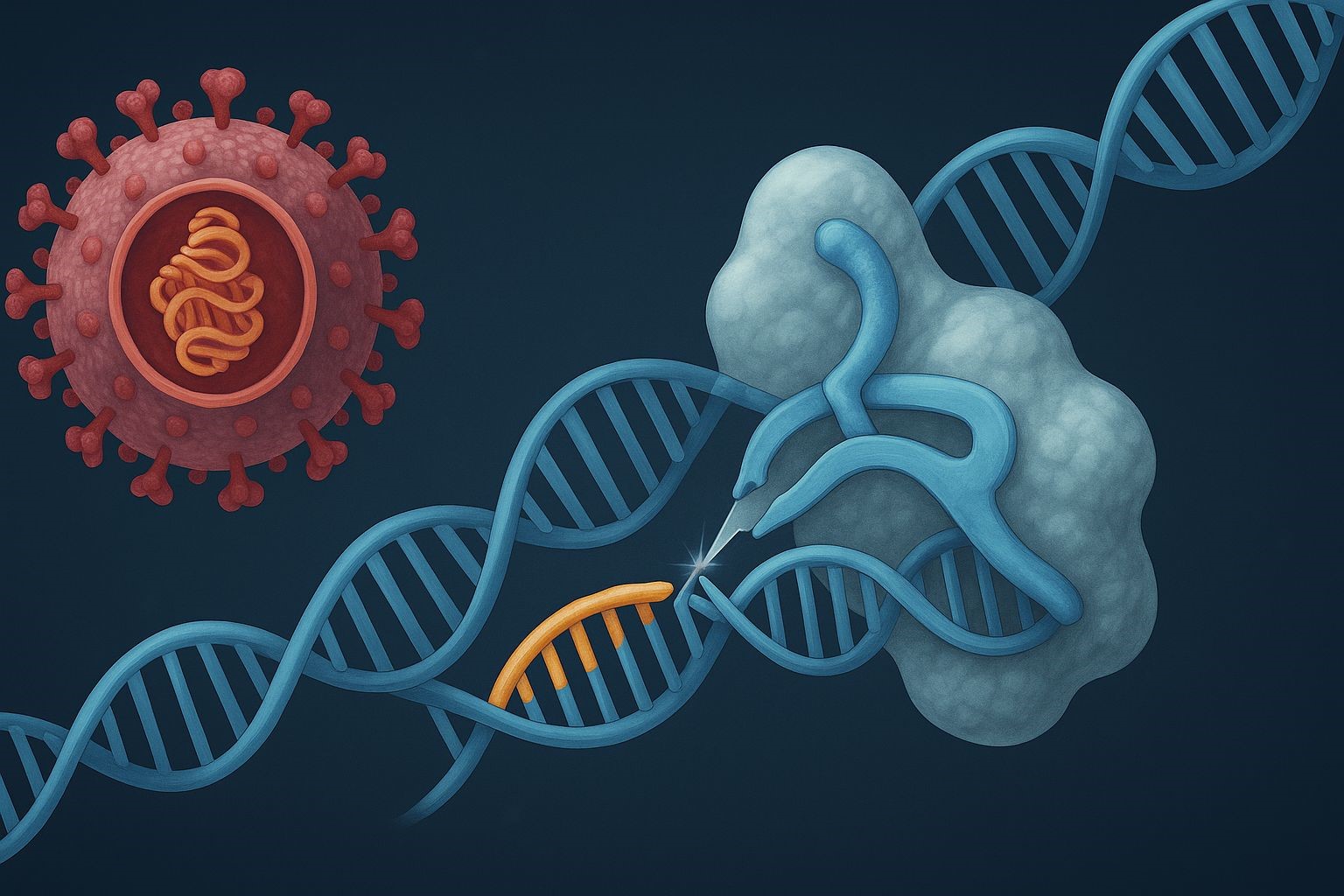
Znanstvenici su po prvi put pomoću CRISPR-a uspjeli ukloniti retrovirus iz DNK živih primata. Time se otvara mogućnost trajnog izlječenja HIV-a – i put prema terapijama za ostale “genetski tvrdokorne” viruse.
Postoji jedna posebna, prilično zlokobna skupina među brojnim vrstama virusa koji izazivaju bolesti kod ljudi: to su retrovirusi. Oni nisu tek „sezonski radnici“ poput virusa gripe, niti povremeni uzročnici bezazlenih osipa, dvodnevno povišene temperature ili dječjih proljeva; oni ne ulaze u naše stanice da bi se u njima dobro 'našikali i napravili kaos' i potom otišli dalje potražiti novog domaćina za svoju zabavu; retrovirusi nisu partijaneri nego skvoteri: nakon infekcije ugnijezde se duboko u staničnu jezgru da bi ondje ostali – zauvijek. Oni doslovno ugrade svoj genetski kod u sâmu DNK zaražene stanice, ponekad postajući trajniji dio našeg genoma nego mnogi naši vlastiti geni.
Kada retrovirus - primjerice virus humane imunodeficijencije, HIV, uzročnik AIDS-a - zarazi stanicu, prvo koristi enzim reverznu transkriptazu kako bi svoj RNK genom pretvorio u DNK, a zatim pomoću enzima zvanog integraza tu svoju 'osobnu iskaznicu' pažljivo ugradi u našu vlastitu DNK. Najčešće meta su naši T-limfociti klase CD4+, ključne stanice ljudskog imunosnog sustava. Jednom kada se virusna DNK smjesti u naš genom, postaje praktički nevidljiva našem imunitetu. Tako može ostati aktivna i stvarati nove viruse – ili, još podmuklije, latentno mirovati, skrivajući se godinama i čekajući priliku da se reaktivira.
Upravo ta sposobnost stvaranja 'tihih rezervoara' čini HIV i druge retroviruse toliko otpornim na terapiju: nijedan antivirusni lijek ne može doprijeti u stanicu duboko unutar jezgre i temo izbrisati virusne gene što su trajno upisani u našoj DNK. Genetska ukorijenjenost virusa – njihova sposobnost da se ugrade u našu DNK i postanu našim neželjenim ali trajnim podstanarima – ono je što ih čini tako tvrdokornima.
Kako HIV postaje dio ljudske DNK
| 1. Ulazak | HIV ulazi u CD4+ T-limfocit |
| 2. Prepisivanje | Virusna RNK se „prevodi“ u DNK pomoću enzima reverzne transkriptaze |
| 3. Integracija | DNK virusa ugrađuje se u ljudski genom pomoću enzima integraze |
| 4. Latencija | Virus miruje neaktivan i skriven |
| 5. Aktivacija | Virus se može reaktivirati i početi se replicirati |
Ali (ovoga puta posrijedi je „ali“ s pozitivnim predznakom), ta činjenica da su dijelovi virusnog koda ugrađeni u formi genskog zapisa unutar naše DNK, čini ih ujedno i savršenim metama za novu vrstu molekularne terapije: CRISPR-Cas9, Nobelovom nagradom ovjenčanu biotehnologiju koja omogućuje kirurški precizno izrezivanje virusnog genetskog materijala iz naše DNK. Kao genetske 'digitalne škare' ili 'gumica za brisanje gena', CRISPR-Cas9 nam po prvi puta daje mogućnost da iz našeg genoma izbrišemo ono što tamo nikada nije ni trebalo biti zapisano.
Prvi stvarni pomaci: kad su makakiji prvi put postali virus-free
Iako je ideja o uklanjanju virusa iz genoma već godinama predmet znanstvene fascinacije, sve do nedavno je bila više teorijska nego stvarna. No, to se promijenilo u kolovozu 2024. godine, kada su istraživači s Lewis Katz School of Medicine pri Sveučilištu Temple, u suradnji s biotehnološkom kompanijom Excision BioTherapeutics, objavili rezultate revolucionarnog eksperimenta: pomoću CRISPR-Cas9 tehnologije uklonili su virusni DNK iz genoma živih primata.

Riječ je o majmunima rezus makaki (Macaca mulatta), primatima čiji je imunološki sustav izuzetno sličan ljudskom i koji se stoga često koriste kao ključni model u istraživanjima zaraznih bolesti, cjepiva i imunoterapije. U svijetu biomedicine, ako neka terapija „prođe“ pokuse i testiranja kod makakija, to se smatra ozbiljnim korakom prema kliničkoj primjeni na ljudima.
Zbog etičkih i biosigurnosnih razloga, u navedenom eksperimentu na majmunima nije korišten HIV već njegov bliski virusni rođak – SIV (simian immunodeficiency virus), koji prirodno inficira primate, ali se ponaša gotovo identično kao HIV: napada T-limfocite, koristi reverznu transkriptazu i integrazu za ugradnju u genom domaćina, stvara latentne rezerve i dovodi do imunodeficijencije. Ta genetska i biološka sličnost s HIV-om čini SIV idealnim modelom za testiranje novih terapija namijenjenih HIV-u. Ako CRISPR-Cas9 može izbaciti SIV iz stanica makakija – može li onda učiniti isto s HIV-om kod ljudi?
Mogu li i ljudi biti virus-free?
Eksperimentalna terapija, nazvana EBT-001, temelji se na posebno dizajniranoj CRISPR tehnologiji koja prepoznaje i „reže“ virusnu DNK unutar stanica. Za razliku od tradicionalnih antiretrovirusnih lijekova, koji virus samo uspavljuju i drže ga pod kontrolom, EBT-001 ide korak dalje – pokušava ga fizički eliminirati i trajno odstraniti iz zaraženih stanica, kao da se ugradnja virusnog genoma nije ni dogodila.
U studiji na makakijima korištena je samo jedna doza EBT-001 primijenjena intravenozno – i odmah je pokazala mjerljiv učinak: rezultati su, čak i kada ih se prezentira znanstvenički suzdržano – spektakularni. U uzorcima tkiva zaraženih makakija više nije bilo detektibilne virusne DNK i to upravo u onim tkivima u čije limfocite virusi najviše vole „useljavati“ i u njima se latentno skrivati: nije ih bilo moguće pronaći ni u limfnim čvorovima, ni u slezeni, niti u stanicama koštane srži. Virusni kod je nakon samo jedne doze lijeka bio potpuno i trajno fizički uklonjen iz genoma zaraženih stanica.
Povrh toga, nije bilo nikakvih nuspojava terapije EBT-001-om: tijekom višemjesečnog praćenja nakon primjene jedne injekcije, životinje nisu pokazivale nikakve znakove toksičnosti, upale, autoimunih reakcija ni oštećenja organa; nisu zabilježene nikakve negativne promjene u hematološkim i biokemijskim parametrima, niti u funkciji jetre, bubrega, slezene ili limfnog sustava. Ukratko, organizam je tretman podnio kao da se ništa izvanredno nije dogodilo – osim što je iz njega nestao virus. I što je možda još fascinantnije – kod nekih pokusnih životinja je opaženo poboljšanje općeg imunosnog statusa.
Kako CRISPR-Cas9 reže virus iz DNK
| 1. Ciljanje | CRISPR-Cas9 prepoznaje točnu sekvencu virusne DNK integrirane u stanični genom |
| 2. Rezanje | Enzim Cas9 reže virusnu DNK na precizno određenom mjestu |
| 3. Popravak | Stanica koristi vlastite mehanizme da zalijepi DNK – ali sada bez virusnih dijelova |
| 4. Rezultat | Virus više nije prisutan u stanici – ni aktivno, ni latentno |
Sve to zajedno znači samo jedno - da koncept djeluje: CRISPR-Cas9 može pronaći i ukloniti virus iz genoma složenog, živog organizma – bez da taj organizam išta primjetno pati. Posrijedi je prva uspješna demonstracija da je moguće izbrisati retrovirusnu infekciju na kompleksnom, višestaničnom biću koje nije laboratorijski miš ili stanična kultura, i to ne supresijom replikacije (sprječavanjem umnožavanja virusa), nego doslovnim „izrezivanjem“ virusa iz DNK. Sada dakle više ne govorimo o terapiji koja drži virus pod nadzorom, već o kompletnom funkcionalnom izlječenju – o modelu kojim se virusni genom može precizno „iščupati“ i zauvijek ukloniti iz staničnog genoma.
EBT-101: Prvi CRISPR lijek protiv HIV-a koji se testira na ljudima
Nakon što je EBT-001 kod makakija dokazao da je moguće sigurno i učinkovito ukloniti retrovirusnu DNK iz živog organizma, znanstvenici su napravili sljedeći logični korak: razvili su ljudsku verziju iste terapije nazvanu EBT-101 i započeli klinička ispitivanja na stvarnim pacijentima.
EBT-101 koristi istu osnovnu platformu – CRISPR-Cas9 sustav programiran da prepozna i izreže specifične sekvence DNK koje je HIV integrirao u genom zaraženih stanica. No u ovom slučaju, terapija je dodatno modificirana za sigurnost i preciznost u ljudskim stanicama: kao vektor za dostavu genetskih CRISPR-„škara“ u tijelo koristi se bezopasni AAV (adeno-associated virus), a istovremeno se napada na više lokusa u HIV-genomu kako bi se spriječilo da virus preživi čak i ako jedan cilj promakne CRISPR-u.

Cijeli projekt vodi biotehnološka tvrtka Excision BioTherapeutics, koja je terapiju razvila u suradnji s istraživačima s Templea i Sveučilišta Nebraska. Kliničko ispitivanje faze I/II odobreno je od strane američke FDA (Food and Drug Administration) još 2022. godine i trenutno uključuje dobrovoljce koji žive s HIV-om, ali imaju potpuno suzbijenu virusnu replikaciju zahvaljujući ART-u (antiretrovirusnoj terapiji), kombinaciji triju lijekova koji uzajamnom sinergijom uspijevaju kod pacijenata držati HIV u „spavajućem“, latentnom obliku – ali ga nisu sposobni posve eliminirati iz organizma oboljele osobe.
Prvi preliminarni rezultati testiranja na ljudskim dragovoljcima objavljeni u svibnju 2024. pokazali su da je terapija EBT-101 doista bila sigurna i dobro podnošljiva kod ljudi – no za sada bez potpunog učinka kakav je postignut s EBT-001 kod makakija. Naime, kod sudionika koji su nakon primjene CRISPR-lijeka prestali uzimati standardnu ART terapiju, HIV se s vremenom ponovno aktivirao. Ipak, jedan od njih uspio je zadržati virus pod kontrolom čak 16 tjedana bez lijekova – znatno dulje nego što je uobičajeno – što sugerira da je EBT-101 ipak imao određeni učinak.
Istraživački tim najavljuje nastavak testiranja korištenjem većih doza i novih, unaprijeđenih sigurnosnih protokola. Sudionici će nakon jednokratne injekcije EBT-1010 biti praćeni mjesecima, a istraživači će pratiti znakove potencijalnih nuspojava, imunoloških reakcija, ali i – ono najvažnije – pojavu (ili izostanak) reaktivacije HIV-a nakon prestanka uzimanja klasične terapije. Ako i bez primjene antiretrovirusnih lijekova HIV ostane neaktivan i nedetektibilan, bit će to prvi dokaz da CRISPR-Cas9 može funkcionalno izliječiti HIV infekciju kod ljudi.
Širi potencijal: tko još nosi virus u svom genomu?
HIV možda jest najpoznatiji retrovirus koji koristi genom domaćina kao skrovište, ali nije i jedini. CRISPR-terapije koje ciljaju na virusnu DNK mogle bi u budućnosti pronaći primjenu i kod niza drugih virusa koji imaju sličnu naviku – bilo da se radi o pravoj integraciji u ljudski genom, bilo o trajnoj prisutnosti virusne DNK unutar ljudskih stanica.
HTLV-1 i HTLV-2 -- Poput HIV-a, i humani T-limfotropni virusi (HTLV) pripadaju retrovirusima. HTLV-1 je prvi ljudski retrovirus koji je ikad otkriven (1980-ih); povezan je s rijetkim oblicima leukemije i mijelopatije, prenosi se putem krvi, seksualnim kontaktom, dojenjem i transplantacijama (kao i HIV), a njegovo integriranje u genom T-limfocita čini ga otpornim na klasične terapije. Za sada ne postoje ispitivanja CRISPR-Cas9 terapije u kliničkoj fazi, ali istraživanja in vitro već traju – osobito u Japanu, gdje je HTLV-1 endemičan.
HBV – Hepatitis B virus -- Iako nije retrovirus, HBV ostavlja za sobom stabilnu cirkularnu formu DNK (tzv. cccDNA) u jezgri hepatocita, stanica jetre. U određenim slučajevima čak se i integrira u genom hepatocita, što povećava rizik od raka jetre. Više istraživačkih timova već razvija CRISPR-Cas9 pristupe za razgradnju cccDNA, a neki su kandidati već ušli u pretkliničku fazu ispitivanja.
HPV – Human papillomavirus -- Neki visoko rizični sojevi HPV-a, poput HPV-16 i HPV-18, mogu se trajno integrirati u genom epitelnih stanica i time pokrenuti maligne, kancerogene promjene. Zbog jasne povezanosti s rakom vrata maternice, analnog područja i ždrijela, razvijaju se eksperimentalne CRISPR-terapije koje ciljaju E6 i E7 onkogene, gene odgovorne za malignu staničnu transformaciju. Ispitivanja su za sada ograničena na laboratorijskae pokuse na kulturama stanica i životinjskim modelima.
EBV – Epstein-Barr virus -- Trajno boravi u B-limfocitima, najčešće u latentnom obliku. Povezuje se s nizom bolesti, od mononukleoze do malignog limfoma. Neki istraživački timovi trenutno razvijaju CRISPR-terapije koje ciljaju virusnu latenciju, pokušavajući ukloniti virusnu DNK bez uništavanja domaćinske stanice. Radi se o vrlo izazovnom pristupu, koji je tek u ranoj eksperimentalnoj fazi.
CMV – Citomegalovirus -- posebno opasan za imunokompromitirane bolesnike, CMV ostaje u organizmu latentno i može se reaktivirati. Iako još nema konkretnih CRISPR-terapija za CMV, konceptualno se radi o sličnom problemu kao kod EBV-a – stanična latencija na koju bi se moglo ciljati preciznom genskom terapijom.
Molekularna kirurgija: skalpel za izlječenje DNK
Pojava CRISPR-tehnologije donijela je novu dimenziju u borbi protiv virusa koji ne samo da napadaju organizam, nego ga i trajno mijenjaju na razini DNK. Sada prvi put imamo alat koji nije samo antivirusni lijek, kemijsko oružje protiv infekcije, nego molekularni skalpel za uklanjanje svih tragova infekcije – i to ne kemijskim putem, nego fizički, strukturalno.
Ipak, premda su se prvi koraci (poput EBT-001 i EBT-101) pokazali vrlo obećavajući, još smo daleko od rutinske primjene takvih terapija. Sigurnost, preciznost i etičke dileme – osobito u vezi „prekrajanja“ i uređivanja ljudskog genoma – zahtijevaju pažljivo i dugotrajno testiranje. Osim toga, virusi poput EBV-a i HBV-a ponašaju se složenije i ne daju se lako „uhvatiti“ za rep kao što to teorijski možemo s HIV-om.
Ipak, trend je jasan: budućnost borbe protiv kroničnih virusnih infekcija sve se više seli iz područja farmakologije u domenu molekularne kirurgije, tamo gdje se bolest neće samo liječiti – nego uklanjati iz temelja.
To bi bilo kao da su liječnici prvi put dobili alat za resetiranje zdravlja na početne postavke – one kodirane u našem netaknutom, zdravom genomu. Ali prije nego što se to dogodi, morat ćemo pažljivo pročitati što točno piše „između redaka“ zapisanih u genima u našoj DNK. I morat ćemo osigurati da brišemo samo ono što doista treba nestati.
. . .

Igor „Doc“ Berecki je pedijatar-intenzivist na Odjelu intenzivnog liječenja djece Klinike za pedijatriju KBC Osijek. Pobornik teorijske i praktične primjene medicine i znanosti temeljene na dokazima, opušta se upitno ne-stresnim aktivnostima: od pisanja znanstveno-popularnih tekstova u tiskanom i online-izdanju časopisâ BUG, crtkanja računalnih i old-school grafika i dizajna, zbrinjavanja pasa i mačaka, fejsbučkog blogiranja o životnim neistinama i medicinskim istinama, sve do kuhanja upitno probavljivih craft-piva i sasvim probavljivih jela, te neprobavljivog sviranja bluesa.























