Nobelova nagrada za fiziologiju ili medicinu 2023. za otkrića koja su omogućila razvoj mRNK cjepiva

Nobelova nagrada za fiziologiju ili medicinu 2023. dodijeljena je Katalin Karikó i Drewu Weissmanu za njihova otkrića u vezi s modifikacijama nukleotidnih baza u mRNK
Dvoje ovogodišnjih laureata Nobelove nagrade svoja su revolucionarna otkrića o načinu na koji stanice prepoznaju i reagiraju na različite oblike glasničke ribonukleinske kiseline (mRNK) objavili još davne 2005. godine, da bi se petnaest godina kasnije tijekom pandemije COVID-19 koja se globalno proširila 2020., ta otkrića pokazala ključnim za razvoj učinkovitih mRNK cjepiva. Svojim otkrićima koja su iz temelja promijenila razumijevanje interakcije mRNK s našim imunološkim sustavom, Katalin Karikó i Drew Weissman su omogućili razvoj brzih i pouzdanih metoda proizvodnje cjepiva tijekom jedne od najvećih prijetnji ljudskom zdravlju u moderno doba.
Danas je Nobelova komisija švedskog Karolinska instituta, kao što to čini svake godine u ovo doba, objavila dodjelu Nobelove nagrade za područje fiziologije ili medicine ovom biokemijsko-imunološkom znanstvenom dvojcu.
Cjepiva prije mRNK
Cijepljenje je postupak koji potiče stvaranje imunološkog odgovora na specifičnog uzročnika bolesti. Takva unaprijed stvorena imunološka reakcija daje tijelu prednost u borbi protiv bolesti u slučaju pravog kontakta s tim uzročnikom. Još dugo prije stvaranja koncepta i realizacije mRNK cjepiva postojala su cjepiva koja su se temeljila na drukčijim biotehnološkim osnovama, primjerice ona zasnovana na umrtvljenim ili oslabljenim virusima, kao što su cjepiva protiv dječje paralize, ospica i žute groznice: Nobelovu nagradu za fiziologiju ili medicinu je 1951.godine dobio Max Theiler za razvoj cjepiva protiv žute groznice.
Zahvaljujući napretku molekularne biologije, tijekom posljednjih desetljeća razvijena su cjepiva koja se temelje na pojedinačnim virusnim komponentama, a ne na cijelim virusima: cjepiva protiv virusa hepatitisa B i humanog papiloma virusa (HPV) načinjena su korištenjem dijelova virusa, točnije rečeno korištenjem genetskog koda koji kodira proteine na površini virusa. Štoviše, dijelovi virusnog genetskog koda mogu se premjestiti na bezopasni virus nositelj, tzv. „vektor“ (ova se metoda koristi u cjepivima protiv virusa ebole). Kada se primjenjuju vektorska cjepiva, u našim stanicama se proizvodi virusni protein, a naš imunološki sustav u kontaktu s tim proteinom stvara snažan imunološki odgovor protiv ciljanog virusa, premda nije bio izložen infekciji tim virusom.

Jedan od glavnih nedostataka tih „starijih“ tehnika proizvodnje cjepiva temeljenih na cijelom virusu, proteinu ili vektoru temelji se na korištenju staničnih kultura, što je proces koji zahtijeva relativno skupe, komplicirane i spore resurse koji isključuju mogućnost brze proizvodnje novih cjepiva u pokušaju promptnog odgovora na epidemije i pandemije bolesti izazvane nekim do tada nepoznatim uzročnikom. Stoga su istraživači dugo pokušavali razviti tehnologije proizvodnje novih cjepiva koje bi bile neovisne o kulturama stanica, ali to se uporno pokazivalo kao nepremostiv problem. Sve do inovativnih otkrića Katalin Karikó i Drewa Weissmana.
Transkribirana mRNK cjepiva: obećavajuća ideja
U našim stanicama, genetske informacije koje su kodirane u DNK prenose se na glasničku RNK (mRNK), koja se u staničnim ribosomima koristi kao „špranca“ za proizvodnju proteina. Tijekom 1980-ih uvedene su učinkovite metode za proizvodnju mRNK bez stanične kulture, nazvane in vitro transkripcija.
Ovaj odlučujući korak je ubrzao razvoj primjene molekularne biologije u velikom broju biomedicinskih područja. Već tada su i ideje o korištenju mRNK za cjepiva i liječenje također uzele maha, ali su postojale brojne prepreke: in vitro transkribirana mRNK smatrala se nestabilnom i zahtijevala je korištenje složenih, sofisticiranih lipidnih sustava nosača i često je izazivala neželjene upalne reakcije. Stoga je entuzijazam za razvoj mRNK tehnologije u kliničke svrhe u početku bio ograničen.
No, ove prepreke nisu obeshrabrile mađarsku biokemičarku Katalin Karikó, koja je bila posvećena razvoju metoda za terapijsko korištenje mRNA. Tijekom ranih 1990-ih, dok je još bila asistentica na Sveučilištu u Pennsylvaniji, ostala je vjerna svojoj viziji realizacije mRNA kao ljekovitog sredstva, unatoč tome što je nailazila na poteškoće u financiranju svojih istraživanja. Njezin novi kolega na njezinu sveučilištu bio je imunolog Drew Weissman koji je istraživao dendritične stanice i njihove funkcije u imunološkom nadzoru i aktivaciji imunoloških odgovora izazvanih cjepivom. Potaknuta Weissmanovim novim idejama, započela je plodna suradnja fokusirana na istraživanje načina na koji različite vrste RNK djeluju na ljudski imunološki sustav.
Ključna promjena
Karikó i Weissman su opazili da dendritične stanice prepoznaju in vitro transkribiranu mRNK kao stranu tvar, s posljedičnim procesima imunološke aktivacije i otpuštanja upalnih signalnih molekula. Kada su se upitali zašto je in vitro transkribirana mRNK prepoznata kao strana (dok primjerice in vivo mRNK iz stanica sisavaca ne izaziva takvu reakciju), Karikó i Weissman su shvatili da moraju postojati neka kritična svojstva koja uzrokuju drukčiji odgovor na različite tipove mRNK.
Svaka RNK sadrži četiri baze: adenozin, uracil, gvanin i citozin (skraćeno A, U, G, C) koje odgovaraju A, T, G, C slovima genetskog koda u DNK. Karikó i Weissman su pretpostavili da su neželjene upalne reakcije posljedica nepostojanja promijenjenih (modificiranih) baza u in vitro transkribiranoj RNK. Kako bi to istražili, u laboratoriju su proizveli varijante mRNK, od kojih je svaka imala jedinstvene kemijske promjene u svojim bazama, a potom su ih u laboratoriju nanijeli na dendritične stanice. Rezultati su bili fascinantni: kada su dendritične stanice izložene molekulama mRNK koje su imale modficirane baze upalni odgovor je gotovo posve izostao.
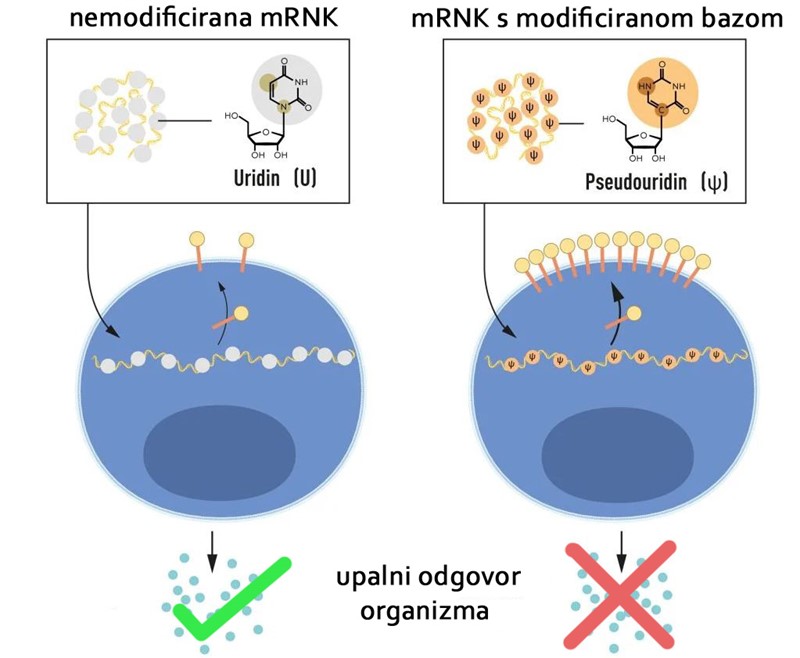
To je bila ključna promjena paradigme u razumijevanju načina na koji stanice prepoznaju i reagiraju na različite oblike mRNK. Karikó i Weissman su shvatili da njihovo otkriće ima veliki potencijal za korištenje mRNK kao terapije, a rezultate svojih istraživanja su objavili 2005., petnaest godina prije pandemije COVID-19.
U daljnjim studijama objavljenim 2008. i 2010., Karikó i Weissman su dokazali da primjena mRNK s modificiranim bazama značajno povećava proizvodnju proteina u usporedbi s nemodificiranom mRNK. Svojim otkrićima da modifikacije baza smanjuju upalne reakcije i povećavaju proizvodnju proteina, Karikó i Weissman su eliminirali kritične prepreke na putu do kliničke primjene mRNK.
mRNK cjepiva iskazuju svoj potencijal
Posljedično njihovim otkrićima, zanimanje za kliničku primjenu modificirane mRNK počelo je jačati, te je već 2010. nekoliko imunoloških i farmaceutskih laboratorija radilo na razvoju mRNK tehnologije, prvenstveno na proizvodnji cjepiva protiv Zika-virusa i MERS-CoV, uzročnika bolesti nazvane „Middle East Respiratory Syndrome“ (MERS, 2012. godine), usko povezane s ranijim akutnim respiratornim sindromom (SARS, 2002. i 2003. godine), te s kasnijim SARS-CoV-2 virusom, uzročnikom COVID-19. Dakle, tehnologija izrade mRNK cjepiva protiv koronavirusnih infekcija započela je s razvojem još 2012. godine, skoro desetljeće prije pandemije COVID-19.

Zahvaljujući iskustvu i znanju stečenim na istraživanjima i izradi mRNK cjepiva protiv MERS-Cov virusa, rekordnom su brzinom razvijena dva bazno modificirana mRNK cjepiva koja kodiraju površinski protein SARS-CoV-2 vrlo brzo nakon izbijanja pandemije COVID-19, što je omogućilo da oba cjepiva budu odobrena već u prosincu 2020., sa zaštitnim učinkom od oko 95%.
Impresivna fleksibilnost i brzina kojom se mogu razviti mRNK cjepiva utiru put korištenju tehnoloških rješenja u proizvodnji cjepiva i protiv drugih zaraznih bolesti. Štoviše, preliminarni rezultati novijih istraživanja ukazuju da bi se u budućnosti mRNK tehnologija mogla koristiti i za proizvodnju i staničnu isporuku terapeutskih proteina kod mnogih bolesti temeljenih na autoimunim mehanizmima, kao i za liječenje nekih vrsta raka.
Cjepiva su spasila milijune života i spriječila razvoj teških oblika bolesti kod još većeg broja drugih bolesnika, omogućivši nacijama da se nakon pandemijskog lockdowna otvore i vrate u normalne životne uvjete. Svojim temeljnim otkrićima o važnosti modifikacija baza u mRNK, ovogodišnji dobitnici Nobelove nagrade kritički su pridonijeli ovom transformativnom razvoju tijekom jedne od najvećih zdravstvenih kriza našeg vremena, kaže se u službenom priopćenju izdanom povodom ovogodišnje dodjele Nobelove nagrade za fiziologiju ili medicinu.
Igor „Doc“ Berecki je pedijatar-intenzivist na Odjelu intenzivnog liječenja djece Klinike za pedijatriju KBC Osijek. Pobornik teorijske i praktične primjene medicine i znanosti temeljene na dokazima, opušta se upitno ne-stresnim aktivnostima: od pisanja znanstveno-popularnih tekstova i objavljivanja ilustracija u tiskanom izdanju časopisâ BUG, crtkanja računalnih grafika i primijenjenog dizajna, zbrinjavanja pasa i mačaka, fejsbučkog blogiranja o životnim neistinama i medicinskim istinama, sve do kuhanja upitno probavljivih craft-piva i sasvim probavljivih jela, te neprobavljivog sviranja bluesa.























