Jednostavno rješenje za onečišćenje fluorom
Organski spojevi koji sadrže fluor stalna su opasnost za čovjekovo zdravlje i zdravlje čovjekovog okoliša. No evo rješenja: zove se natrijeva lužina – uz jedan važan dodatak.

Posao kemičara je nekoć bio lakši, ali na svoj način i teži nego danas. Kako to? Bio je lakši jer se uglavnom svodio na rad sa dva reagensa, na kiselinu i lužinu. Kemičar bi prvo pokušao razložiti novu tvar kiselinom, a ako to ne ide onda bi pokušao lužinom. U slučaju da ne uspije ni s kiselinom ni s lužinom, postepeno bi povećavao koncentraciju reagensa uz grijanje reakcijske smjese na višu temperaturu. Kad bi konačno razložio uzorak, odvojio bi produkte kristalizacijom, destilacijom ili ekstrakcijom. Onda bi ponovio postupak na produktima: ako je u prvom postupku razlagao kiselinom, u drugom bi razlagao lužinom – i obratno.
Danas kada postoje desetine vrlo moćnih reagensa u organskoj kemiji (za jedan je takav ove je godine dodijeljena Nobelova nagrada) nema više potrebe za metodama prvih kemičara i njihovih prethodnika alkemičara. Za lužinom i kiselinom moderni će kemičar rijetko posegnuti kad želi od jedne tvari pripraviti drugu. Razlog tome je i što su lužine i kiseline nespecifični reagensi, pa se nikad ne zna kako će i na koji dio molekule djelovati – i hoće li uopće djelovati.
Zbog svega rečenog (a još više zbog nerečenog) jako sam se iznenadio kada sam pročitao kako su kineski i američki znanstvenici uspjeli riješiti problem razgradnje fluoriranih organskih spojeva na način starih (al)kemičara: natrijevim hidroksidom. Štoviše, rezultate svojih istraživanja uspjeli su objaviti u časopisu Science, što ukazuje na njihovu važnost. Naslov rada je posve kratak: „Low-temperature mineralization of perfluorocarboxylic acids (Mineralizacija perfluorkarboksilnih kiselina pri niskoj temperaturi)“.
Riječ je o tome da su polifluoralkilne i perfluoralkilne tvari (poly- and perfluoroalkyl substances, PFAS) vrlo traženi, no i vrlo štetni organski spojevi (poly znači da su neki, a per da su svi vodikovi atomi na alkilnom lancu zamijenjeni atomima fluora). Nije tu riječ samo o teflonu, freonima (u hladnjacima) i halonima (u vatrogasnim aparatima), nego i o površinski aktivnim tvarima (surfaktantima) koje se upotrebljavaju u tekstilnoj i prehrambenoj industriji.
Ovo posljednje se odnosi poglavito na perfluorkarboksilne kiseline (perfluorocarboxylic acids, PFCA), koje su glavna tema spomenutog rada.

Mnogo tih spojeva (PFAS) dospijeva u vode – i tu počinje nevolja. Utvrđeno je naime da PFAS štete štitnjači, izazivaju oštećenja jetre i povisuju razinu kolesterola u krvi, a usto se povezuju sa slabljenjem imunološkog sustava i smanjenjem porođajne težine novorođenčadi. Usto se, što je najgore, mogu povezati i s nekoliko vrsta tumora. Iako se pitka voda pročišćava na te otrove (ionskim izmjenjivačima ili aktivnim ugljenom), problem se time samo odlaže – jer što da se čini s aktivnim ugljenom i smolom ionskog izmjenjivača nakon adsorpcije fluornih spojeva, naime PFAS?
Upravo tome služi metoda izložena u navedenom radu. Ona je krajnje jednostavna: perfluorkarboksilne kiseline se kuhaju desetak sati u otopini natrijeva hidroksida (NaOH) na temperaturi od 80 – 120 oC (low-temperature). Namjerno sam napisao „u otopini“, a ne „u lužini“ jer se riječ „lužina“ odnosi samo na vodenu otopinu. Ovdje je, istina, također riječ o vodenoj otopini, ali otopini kojoj je dodan važan sastojak, dimetil-sulfoksid (DMSO). Taj me podatak podsjetio na jednu knjigu moje mladosti u kojoj je pisalo da bi DMSO, organsko otapalo formule (CH3)2SO, mogao postati nekakva panaceja modernog doba, jer navodno relaksira mišiće, potiče cirkulaciju, stišava upalu zglobova i čini što još sve ne za čovjekovo zdravlje. Što je u toj priči istina, ne znam, no ako se nije iskazao u medicini, DMSO se pokazao u kemijskoj tehnologiji, no opet s istim ciljem, ciljem zaštite zdravlja.
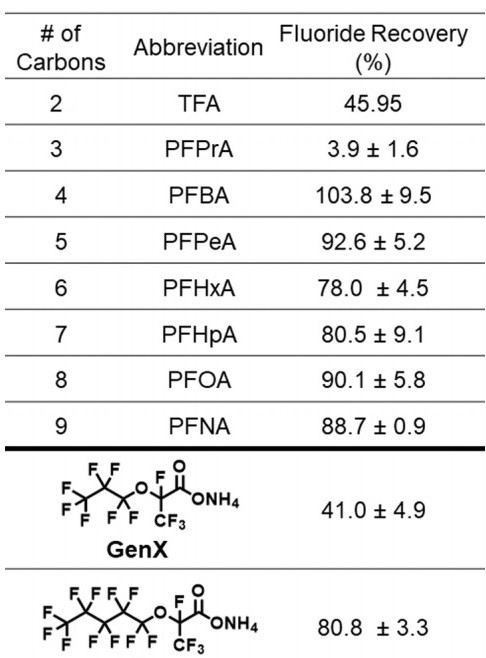
Dok kuhanje u čistom DMSO prevodi perflorkarboksilne kiseline u perfluoralkane, dakle u teflonu slične tvari, dodatak vode i natrijeva hidroksida okreće reakciju u posve drugom smjeru.
Pri tim uvjetima gotovo se sav fluor prevodi u fluoride, F- (zbog toga riječ mineralization u naslovu), a ostatak molekule (ugljik i kisik) u jednostavne organske kiseline, koje se, kao i fluoridi, mogu iskoristiti u kemijskoj proizvodnji.

Iza te naoko jednostavne pretvorbe stoji vrlo složen splet umreženih kemijskih reakcija, koji su autori spomenutog rada uspjeli dobrim dijelom razmrsiti. A nama ostaje za nadati se da će nova metoda razgradnje organskih spojeva fluora uskoro naći svoj put iz kemijskog laboratorija do industrijskog pogona.

Nenad Raos je kemičar, znanstveni savjetnik u trajnome zvanju, koji je radio do umirovljenja 2016. godine u zagrebačkom Institutu za medicinska istraživanja i medicinu rada (IMI). Autor je i koautor oko 200 znanstvenih i stručnih radova iz područja teorijske (računalne) kemije, kemije kompleksnih spojeva, bioanorganske kemije i povijesti znanosti. Bio je pročelnik Sekcije za izobrazbu Hrvatskog kemijskog društva, glavni urednik Prirode te urednik rubrike Kemija u nastavi u časopisu Kemija u industriji. Još od studentskih dana bavi se popularizacijom znanosti. Autor je 3000 znanstveno-popularnih članaka te 13 znanstveno-popularnih knjiga. Ove mu godine izlazi još jedna, „Kemija – muza arhitekture“, koju je napisao u koautorstvu s arhitektom Zvonkom Pađanom.































