Nezapaljiva litij-ionska baterija
U svim litijevim baterijama, ma kakve god bile, nalazi se zapaljivo nevodeno otapalo. No evo novosti, litij-ionske baterije s vodenim elektrolitom

Pitanje zašto se u litij-ionskih baterijama nalaze za zdavlje i okoliš štetna te nadasve opasna, zapaljiva otapala (uglavnom esteri ugljične kiseline), a ne voda, svodi se na pitanje zašto se elektrolizom vodene otopine modre galice na katodi izlučuje bakar, a elektrolizom natrijeva klorida se ne izlučuje natrij nego vodik. Riječ je, ukratko, o tome da postoji minimalni napon, napon razlaganja, pri kojem je elektroliza nečega moguća. Ioni bakra, Cu2+, imaju veći afinitet prema elektronima od iona vodika, H+, a oni opet od iona natrija, Na+, pa se u uređaju za elektrolizi ne mogu stvoriti uvjeti pri kojima bi došlo do izlučivanja natrija, a da se pritom ne bi razvijao vodik. U litij-ionskoj bateriji s vodenim elektrolitom dolazi do slične pojave jer pri njezinom punjenju dolazi prije do elektrolize vode nego do deponiranja litija. Kako onda napraviti takvu bateriju?
Rješenje je salamunsko: treba napraviti bateriju s vodom bez vode. I evo je: u časopisu Matter objavljen je rad kineskih znanstvenika „Enabling high-energy-density aqueous batteries with hydrogen bond-anchored electrolytes“. Ključna riječ je hydrogen bond-anchored electrolyte, elektrolit s usidrenom vodikovom vezom.
Tajna vode je u vodikovoj vezi. Ta desetak puta slabija veza od veze O-H koja drži atome u molekuli H2O, povezuje molekule vode u svakojake strukture čineći od tekuće vode složenu mrežu uzajamno povezanih molekula. Mreža vodikovih veza pogoduje gibanju vodikovih (H+) i hidroksidnih (OH-) iona, zbog čega je voda dobar vodič električne struje. To je dobro, no nije dobro što se zbog toga H+ lakše reducira kada se na elektrodu narine negativan napon, pa se na njoj razvija plinoviti vodik, H2. Ta reakcija, reakcija razvijanja vodika (hydrogen evolution reaction, HER) uništava bateriju.

Rješenje problema autori spomenutog rada pronašli su u tvari koja trga vodikove veze među molekulama vode tako da ih sama s njima stvara. Ta se tvar zove sulfolan. Riječ je o heterocikličkom organskom spoju u čijoj su molekuli za atom sumpora vezana dva atoma kisika. Oni se vežu vodikovom vezom za molekule vode (S=O···H-O), čime razbijaju klastere molekula H2O. Razaranjem sustava vodikovih veza smanjuje se sposobnost vode da vodi vodikove ione, a time i neželjena reakcija razvijanja vodika.
Nažalost, do razvijanja vodika – ali pri nižim naponima – ipak dolazi, jer je litijev titanat, Li4Ti5O12 (LTO), od kojeg je izrađena anoda, katalizator za redukciju iona H+. No i za to ima lijeka, i to u obliku tankog, tek tri nanometra debelog sloja litijeva aluminata, LiAlO2. Usto se, kao dodatna zaštita od razvijanja vodika pri punjenju baterije, na površini elektrode LTO stvara međusloj čvrstog elektrolita (solid electroylte interface, SEI), sastavljen od litijeva fluorida, sulfida, sulfita i karbonata.

Elektrolit za vodenu bateriju je litijeva sol bis(trifluormetan)sulfonimida (LiTFSI) otopljena u smjesi vode i sulfolana u množinskom omjeru 1:1 – što znači da na svaku molekulu vode dolazi jedna molekula sulfolana. Mjerenja su pokazala da nova baterija, s drugom elektrodom (katodom) od litijeva manganata, LiMn2O4 (LMO), ima početnu gustoću energije 141 W h kg-1 koja potom blago opada da bi nakon 1000 ciklusa punjenja i pražnjena iznosila 125 W h kg-1, dakle 70 % početne vrijednosti. To je povezano s promjenom kapaciteta, koji nakon 300 ciklusa iznosi 58 A h kg-1. Radni napon baterije kreće se između 1,3 i 4,7 V.
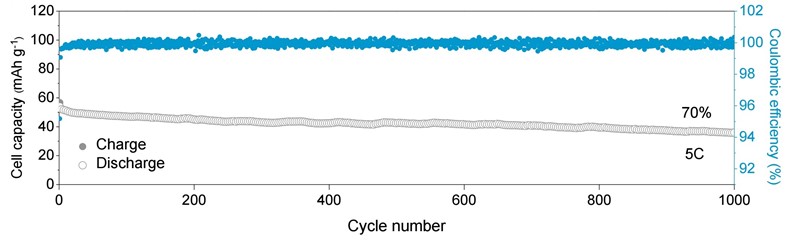
Iako već u naslovu piše da je riječ o bateriji „visoke gustoće energije“ (high-energy-density), ona se po sposobnosti skladištenja energije ipak ne može mjeriti s najboljim litij-ionskim baterijama. No to mnogo ne smeta jer, kao što rekoh, vodena baterija je nezapaljiva, manje je opasna po zdravlje, lakše se reciklira, a i proizvodnja će joj biti jeftinija.

Nenad Raos je kemičar, znanstveni savjetnik u trajnome zvanju, koji je radio do umirovljenja 2016. godine u zagrebačkom Institutu za medicinska istraživanja i medicinu rada (IMI). Autor je i koautor oko 200 znanstvenih i stručnih radova iz područja teorijske (računalne) kemije, kemije kompleksnih spojeva, bioanorganske kemije i povijesti znanosti. Bio je pročelnik Sekcije za izobrazbu Hrvatskog kemijskog društva, glavni urednik Prirode te urednik rubrike Kemija u nastavi u časopisu Kemija u industriji. Još od studentskih dana bavi se popularizacijom znanosti. Autor je 3000 znanstveno-popularnih članaka te 13 znanstveno-popularnih knjiga. Upravo mu je izašla još jedna, „Kemija – muza arhitekture“, koju je napisao u koautorstvu s arhitektom Zvonkom Pađanom.















