Odavna poznati metal našao je svoju potencijalnu primjenu u cink-zrak bateriji
U vodikovoj bateriji spajaju se vodik i kisik u vodu, no pri tome ne nastaje ni eksplozija ni plamen nego električna struja. No evo takve baterije i na cink – zahvaljujući pronalasku dvije membrane.

Metalurgija je borba čovjeka protiv prirode, korozija je borba prirode protiv čovjeka. Ili: što čovjek reducira, to priroda oksidira. No kada se spustimo s neba na zemlju, reći ćemo da se od 88 kemijskih elemenata koji se pojavljuju u prirodi, samo dvadesetak pojavljuje u nevezanom, samorodnom stanju; od metala treba spomenuti zlato, srebro, bakar, platinu, arsen, živu, željezo, antimon i bizmut – no i ti se elementi, metali, češće (osim zlata i platine) pojavljaju u obliku oksida, sulfida i silikata, svake vrste. U prirodi postoje dva jaka reagensa, voda i kisik, te se oni spajaju sa svakim neplementim metalom.
Metali mogu gorjeti, no i polako se spajati s kisikom, korodirati. Pri tome dolazi, u prisustvu vode, do prijelaza elektrona s metala na kisik. Uzmimo za primjer cink. Cink gubi dva elektrona (Zn → Zn2+ + 2e-) koji se potom spajaju s kisikom, pri čemu nastaju hidroksidni ioni (O2 + 2H+ + 4e- → 2OH-). Elektroni putuju po površini metala, od mjesta gdje ima manje do mjesta gdje ima više kisika – i tako metal korodira, procesom koji se zove diferenijalna aeracija. No manimo se stručnih riječi. Bi li se taj proces, proces korozije cinka, mogao iskoristiti za dobivanje električne struje, drugim riječima za konstrukciju električne baterije?
Kada se pišu kemijske formule i jednadžbe onda je lako, no kada se dođe do izvedbe dolaze na vidjelo (nepremostive) teškoće. U reakciji elektrona s kisikom nastaju hidroksidni ioni, stoga elektrolit postaje lužnat. Lužina ne reagira s kisikom, ali reagira s ugljikovim dioksidom, kojeg ima u zraku. Reakcija kisika otopljenog u vodi, bilo da je riječ o njegovoj redukciji (ORR, oxygen reduction reaction), pri izbijanju baterije, bilo da je riječ o njegovom nastajanju oksidacijom hidroksidnih iona (OER, oxygen evolution reaction), pri nabijanju baterije, je spora, pa je treba katalizirati. Usto treba napraviti membranu koje će propušati kisik (zračna katoda), ali i membranu koja će dijeliti katodni od anodnog prostora.
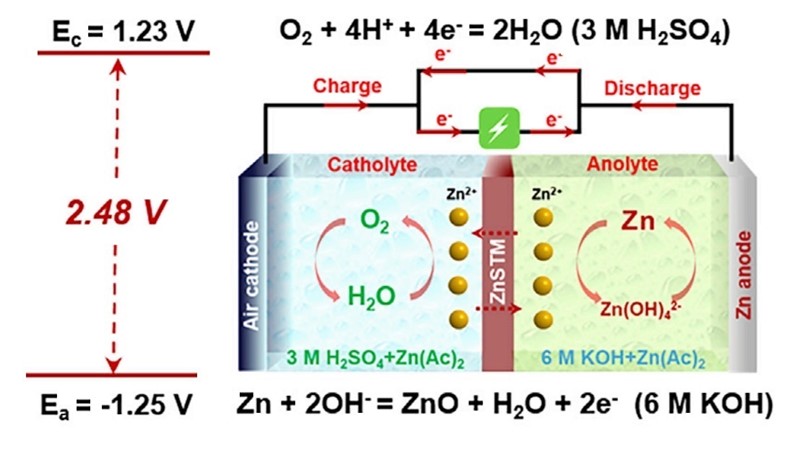
Sve su te probleme riješili kineski znanstvenici te o tome obavijestili javnost u članku objavljenom u časopisu Matter pod naslovom „High-voltage asymmetric metal-air batteries based on polymeric single-Zn2+-ion conductor“.
Zašto je baterija „asimetrična“ (asymmetric)? Zašto što su u katodnom prostoru, onom okrenutom zraku, nalazi koncentrirana sumporna kiselina (koncentracije 3 mol/L ili 294 g/L), a u anodnom prostoru koncentrirana kalijeva lužina (6 mol/L ili 336 g/L). Ne bih vam preporučio ni da ma i polako ulijevate jednu otopinu u drugu, jer bi vam se moglo lako dogoditi da vam kiselina ili lužina završi na odjeći ili (nedajbože) na licu. No tajna je upravo u membrani. Ona propušta cinkove, ali ne vodikove (H+) i hidroksidne (OH-) ione, spajanje kojih je upravo reakcija neutralizacije.

Čudesna membrana temelji se na sasvim običnom (i jeftinom!) polimeru, poliakrilonitrilu, PAN. Polimer i cinkov acetat, Zn(Ac)2, se otope u organskom otapalu, a potom se zagriju na 140 oC. Pri toj se temperaturi lančane molekule polimera povezuju u strukturu nalik na ljestve, u kojoj se nalaze dušikovi atomi sposobni za vezivanje cinkovih iona. Ukratko, nastaje membrana kroz koju prolaze cinkovi ioni (zinc-selective transport membrane, ZnSTM), ali kao što rekoh, ne i ioni H+ i OH-.
Druga, zračna membrana, koja služi kao katoda, zapravo je ugljična elektroda u kojoj su uklopljeni oko nanometar veliki klasteri kobalta. Oni služe kao katalizator. Sve u svemu jednostavne i nadasve jeftine membrane (ZnSTM stoji oko 400 dolara po kvadratnom metru), a i cink je jeftin, daleko jeftiniji i dostupniji od litija – metala na kojem se temelje litij-ionske baterije. (Cink usto nije zapaljiv ni otrovan poput litija, cink je štoviše biogeni element.)

A sada trenutak istine: koliko je takva baterija efikasna? Njome se može postići specifična snaga od 126 mW cm-2, pri gustoći struje 150 mA cm-2. Iskoristivost joj iznosi 76,6 %, no nakon 300 ciklusa punjenja i pražnjenja pada na 70,8 %. I još, na sličan se način mogu se napraviti membrane za kositar (SnSTM) i silicij (SiSTM), no baterije temeljene na ta dva kemijska elementa daju niže napone od cinkove baterije.

Nenad Raos je kemičar, doktor prirodnih znanosti i znanstveni savjetnik u trajnome zvanju, sada u mirovini. Autor je i koautor stotinjak znanstvenih i stručnih radova iz područja bioanorganske i teorijske kemije, molekularnog modeliranja te povijesti kemije i komunikacijskih vještina u znanosti. Još od studentskih dana bavi se popularizacijom znanosti. Sada piše za Čovjek i svemir te, naravno, Bug online. Sedam je godina bio glavni i tehnički urednik časopisa Priroda, a danas je glavni urednik mrežnih stranica Panopticum. Koautor je dva sveučilišna udžbenika i autor 13 znanstveno-popularnih knjiga. Nagrađen je Državnom godišnjom nagradom za promidžbu i popularizaciju znanosti 2003. godine.



























