Iz nečiste vode – električna struja
Nečista voda kao izvor električne struje, kao energent? Zvuči neobično, ali i na tome se radi. Problem je kao uvijek: treba pronaći djelotvoran, a prije svega jeftin katalizator.

Zvuči kao san, kao fantazija ili – u najmanju ruku – kao znanstvena fantastika: dobivanje energije, električne struje iz prljave vode. No kemičaru sama ideja nije strana jer zna da je najvažniji proces u pročišćavanju vode oksidacija organske tvari, a gdje se jedno oksidira drugo se reducira – drugim riječima dolazi do prelaska elektrona s molekule na molekulu. Ako se ta dva procesa odvoje, ako se oksidans i reducens razvoje tako da elektrone razmjenjuju preko električnog voda (da na kažem žice), možemo dobiti električnu struju. No što je oksidans, a što reducens?
Reducens je tvar koja nešto reducira, a sebe oksidira. Oksidans je pak tvar koja čini obratno: drugo oksidira, a sebe reducira. Ili, najjednostavnije, reducens daje, a oksidans prima elektrone. Reducens je organska tvar, tvar koju treba oksidirati, oksidirati do kraja, do vode i ugljikova dioksida. Ništa novo pod suncem, jer na tom principu, principu oksidacije organske tvari, radi većina dezinfekcijskih sredstava, a praktički sva sredstva za pročišćavanje vode. Jer za što služi „aktivni klor“ (klorna voda i hipokloriti) nego za primanje elektrona iz organske tvari koja se nalazi u (onečišćenoj) vodi: H+ + HClO + 2e- → Cl- + H2O.
Klor je element kojeg u prirodi nema u slobodnom stanju. No jednog „hvatača elektrona“ ima svugdje. To je kisik, O2.
No klor je klor, a kisik je kisik. Kisik neće druge oksidirati (a sebe reducirati) sam od sebe. Njega na to treba nečime potaći. To nešto može biti temperatura (paljenje vatre) ili enzimi – katalizatori u tijelu živih bića – koji molekulski kisik (O2) pretvaraju u vodu: 4 H+ + O2 + 4e- → 2 H2O (i u CO2, no i ovo je jednadžbi previše).

Iz svega izloženog krije se jasna spoznaja da je kisik zapravo slabo oksidacijsko sredstvo, usporedimo li ga recimo s hipokloritima (i hipoklorastom kiselinom). I dobro je da je tako. Da nije, svi bismo se pretvorili u pepeo.
Kisik treba, kao što rekoh, nečim aktivirati. Upravo je o tome riječ u znanstvenom radu međunarodne skupine znanstvenika objavljenom u časopisu Molecules: „BaTiO3 functional perovskite as photocathode in microbial fuel cells for energy production and wastewater treatment“. Dug naslov, puno riječi – o čemu se zapravo radi?
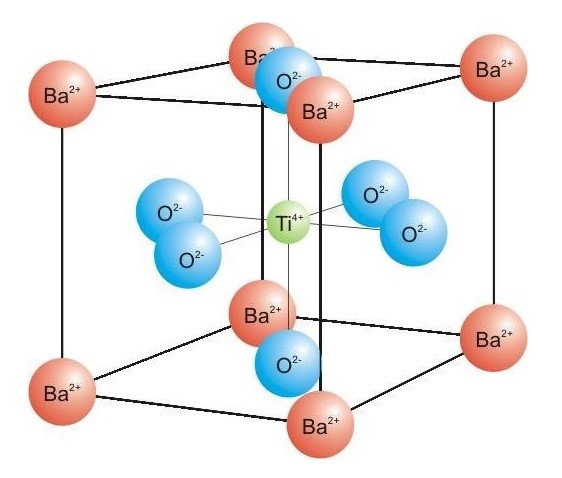
Radi se jednostavno o tome da su znanstvenici napravili elektrodu od barijeva titanata (BaTIO3), materijala analognog mineralu perovskitu (CaTiO3), koja obasjana Sunčevom svjetlošću oksidira organsku tvari i pritom proizvodi električnu energiju. To radi tako da uzima elektrone iz otopine (prljave vode) te ih potom predaje kisiku, O2.
To je stara ideja, ali je izvedba nova. Prije barijeva titanata znanstvenici su iskušavali – kao fotokatalizatore – spojeve platine, rodija i paladija ili pak spojeve lantanida poput LiNbO3 i LiTaO3. Jasno je da je tu riječ o izuzetno skupim materijalima, tako skupim da je besmisleno pomišljati o njihovoj komercijalnoj upotrebi. Nasuprot tome, barijev titanat se priređuje od razmjerno jeftinih sirovina, barijeva karbonata i titanijeva dioksida, vrlo jednostavnim postupkom: dovoljno je dva navedena kemijska spoja pomiješati, a potom iz žariti 12 sati na temperaturi od 600 do 1100 oC.
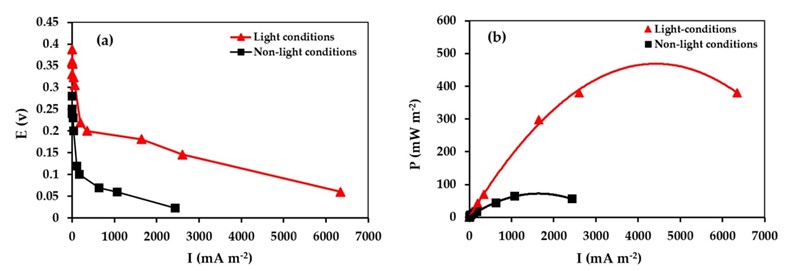
Kada se fotokatoda od barijeva titanata umoči u otpadnu vodu i izloži suncu, ona daje struju napona 0,1 – 0,2 V, a može – u najboljem režimu rada – davati 0,5 W po kvadratnom metru, pa stoga ne samo cijenom nego i efikasnošću nadmašuje dosadašnje fotokatode (0,332 W/m2). To, istina, nije velika snaga, ali je električna energija koja se tako dobiva samo nusprodukt pri pročišćavanju otpadne vode. Nakon 120 sati izlaganja suncu voda se pročisti 90 %, a usto se dobije 0,6 kWh električne energije na 10 m2 fotokatode.
Konačni cilj istraživanja? Eto ga u naslovu: microbial fuel cell (mikrobni gorivni članak), a to znači dobivanje energije oksidacijom goriva (octene kiseline i sl.) što ga proizvode mikrobi razgradnjom otpadne tvari. Tim više što fotokatoda od BaTiO3 može biti i samo katoda. Tada radi u mraku, bez svjetlosti, no s mnogo manjim učinkom (64 mW/m2).

Nenad Raos je kemičar, znanstveni savjetnik u trajnome zvanju, koji je radio do umirovljenja 2016. godine u zagrebačkom Institutu za medicinska istraživanja i medicinu rada (IMI). Autor je i koautor oko 200 znanstvenih i stručnih radova iz područja teorijske (računalne) kemije, kemije kompleksnih spojeva, bioanorganske kemije, povijesti kemije i komunikacijskih vještina u znanosti. Bio je pročelnik Sekcije za izobrazbu Hrvatskog kemijskog društva, glavni urednik Prirode te urednik rubrike Kemija u nastavi u časopisu Kemija u industriji; član je društva ProGeo-Hrvatska i Odjela za prirodoslovlje i matematiku Matice hrvatske. Još od studentskih dana bavi se popularizacijom znanosti. Autor je 15 znanstveno-popularnih knjiga, posljednje dvije su „Kemija – muza arhitekture“ (u koautorstvu sa Zvonkom Pađanom) i „Kemičar u kući – kemija svakodnevnog života“.






















