Vodik u grafenu – uspjeh ili neuspjeh?
Umjesto u stlačenom ili tekućem stanju vodik bi se mogao čuvati i u vezanom stanju – vezan za grafen. Kako to postići kad ni grafen ni njegov pandan grafit ne apsorbiraju H2?

Vodik je gorivo od kojeg se bolje ne može zamisliti. Energetska vrijednost (120 MJ/kg) mu je višestruko veća od energetske vrijednosti zemnog plina (46 MJ/kg), pa i ponajboljeg benzina (52 MJ/kg), a usto njegovim izgaranjem (oksidacijom) ne nastaje ništa drugo osim čiste vode. Namjerno sam napisao „oksidacijom“ jer prije svega mislim na gorivne ćelije, galvanske članke u kojima se vodik spaja s kisikom uz izravno dobivanje električne energije. Vodik se, istina, ne nalazi slobodan u prirodi, no to mnogo ne smeta budući da može poslužiti za pohranu energije iz obnovljivih izvora. Izdašnije i jeftinije nego u električne baterije.
No kako to obično u tehnici (a i u životu) biva, jedna mana može zasjeniti stotinu vrlina. Vodik je izuzetno lagan plin, najlakši u prirodi – dvaput je lakši od helija, a 15 puta od zraka. Ne pomaže ni kada se ukaplji, prevede u tekuće stanje. Gustoća tekućeg vodika iznosi samo 0,07 g/cm3, što znači da je 14 puta lakši od vode. Posljedica toga je da njegova velika energetska vrijednost pada na samo 8,5 MJ/L – u litri tekućeg vodika može se ukladištiti najviše 2,4 kWh električne energije. Dodajmo tome da se tekući vodik mora čuvati pri vrlo niskoj temperaturi, ispod -253 oC (20 K), jer upravo toliko iznosi njegovo vrelište. Gustoća se vodika, kao uostalom svakog plina, može povećati tlačenjem, no tlačenje iziskuje čvrste spremnike, pa što se dobiva na volumenu, gubi se na težini, na debljini stijenki. I evo nas u začaranom krugu: naslov jedne stare ruske knjige (iz 1977. godine) s moje police kaže da je „vodik gorivo budućnosti“ – no budućnost nikako da počne.
No nada umire posljednja. Kada je, dakle, vodik teško čuvati u plinovitom i tekućem stanju, treba ga prevesti u neko drugo, vezano stanje. Jedno od vezanih stanja je vezivanje s grafenima, alotropskim modifikacijama ugljika, ili – kemijski preciznije – derivatima grafita.
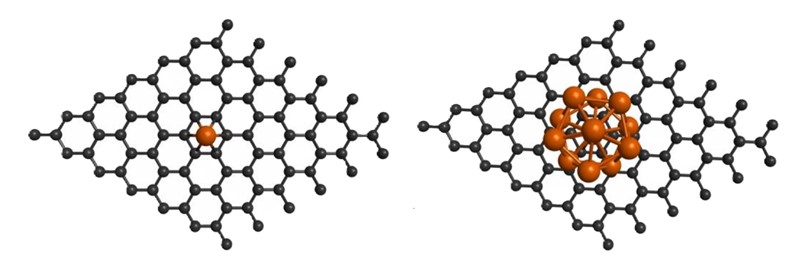
Grafen je za kemičara isto što i grafit ili, bolje reći, najtanji grafit. To je naime samo jedan sloj kovalentnim vezama povezanih atoma ugljika ili – bliže svakodnevnoj predodžbi – heksagonska mreža ugljikovih atoma. I kako sad u tu mrežu smjestiti molekule H2?
Vodik se ne može vezati za grafen, ali se može vezati za atome metala koji su mu vještinom kemičara pridodati. Najjednostavnije je atome metala smjestiti u „očice“ grafitne mreže. U tom se slučaju govori o ukrašenom grafenu (decorated graphene). On može biti „ukrašen“ jednim atomom ili pak njihovim skupom (klasterom). Kojih atoma? Prije svega atomima aluminija, kalcija, litija i titanija, ali i atomima teških metala poput kobalta ili paladija. Zvuči pomalo nestvarno, ali za neveliku rupu na molekuli grafena može se pričvrstiti klaster i od šest poprilično velikih atoma.
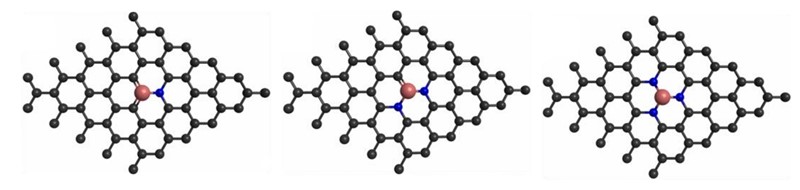
Druga mogućnost modifikacije molekule grafena je dopiranje. To znači da se jedan ugljikov atom na „čvoru“ zamijeni atomom nekog drugog kemijskog elementa (a atomi oko čvora se zamijene s jednim ili više atoma dušika). Taj drugi element obično je litij ili titanij. Što na to reći? Kemičar opterećen nomenklaturom bi rekao da dopirani grafen i nije grafen, nego prije neka vrsta karbida. To se vidi između ostalog i po tome što je formula dopiranog grafena primjerice C7Li, što znači da je svaki osmi ugljikov atom u molekuli zamijenjen atomom litija.
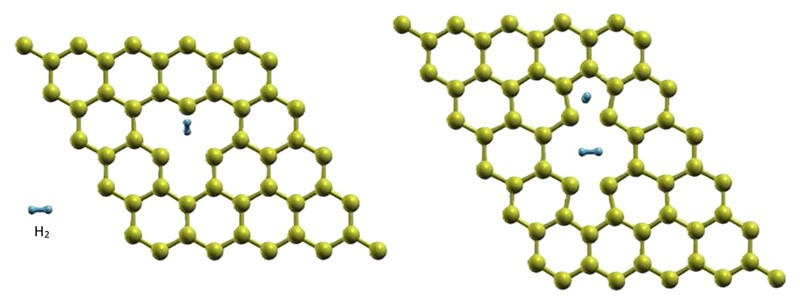
I na kraju dolazimo do najjednostavnije modifikacije molekule grafena – jer ona ne zahtijeva upotrebu nijednog (skupog i teškog) metala. Riječ je naprosto o tome da se grafitna mreža „potrga“ da bi u njoj nastale rupe, šupljine (vacancies), u koje potom mogu lako ući molekule vodika. Šupljine mogu biti toliko velike („dvostruke šupljine“) da u njih može stati i devet molekula H2.
Rješenje je tu, u teoriji i laboratorijskoj praksi, no koliko navedena rješenja imaju tehnološkog smisla? Koliko je bolje čuvati vodik u grafenu nego u obliku tekućine ili stlačenog plina?
Pri normalnom tlaku i temperaturi dopirani grafen C7Li može sadržavati 6,2 % vodika. Od njega je nešto bolji grafen s dvostrukim šupljinama: u njemu može biti i 7,02 % vodika. Mnogo ili malo?
Uzmemo li kao kriterij postavljeni cilj, koji bi se trebao postići već sljedeće, 2025. godine, a to je postizanje gustoće vezivanja vodika od 40 g/L ili 5,5 % mase grafenskog spremnika, vidimo da je cilj postignut. No ako postavljeni cilj prevedemo u energiju pohrane (5,5 % od 121 MJ/kg), vidimo da u kilogram spremnika stane samo 6,7 MJ, dakle oko 1,8 kWh energije. Ili, izrečeno na drugi način, gustoća vodika u spremniku je 0,04 g/cm3, dok je gustoća tekućeg vodika – vidjeli smo – skoro dvaput veća (0,07 g/cm3).
I što na sve to reći? Još smo daleko od (pravog) cilja, ali smo na dobrom putu. Nadajmo se.

Nenad Raos je kemičar, znanstveni savjetnik u trajnome zvanju, koji je radio do umirovljenja 2016. godine u zagrebačkom Institutu za medicinska istraživanja i medicinu rada (IMI). Autor je i koautor oko 200 znanstvenih i stručnih radova iz područja teorijske (računalne) kemije, kemije kompleksnih spojeva, bioanorganske kemije, povijesti kemije i komunikacijskih vještina u znanosti. Bio je pročelnik Sekcije za izobrazbu Hrvatskog kemijskog društva, glavni urednik Prirode te urednik rubrike Kemija u nastavi u časopisu Kemija u industriji; član je društva ProGeo-Hrvatska i Odjela za prirodoslovlje i matematiku Matice hrvatske. Još od studentskih dana bavi se popularizacijom znanosti. Autor je 15 znanstveno-popularnih knjiga, posljednje dvije su „Kemija – muza arhitekture“ (u koautorstvu sa Zvonkom Pađanom) i „Kemičar u kući – kemija svakodnevnog života“.















