Elektrolizom CO2 do goriva i sirovina
Ako se elektrolizira soda-voda dobiva se što i elektrolizom vode – vodik i kisik. No zahvaljujući novom tehnološkom postupku, umjesto vodika nastaje eten, etanol, mravlja kiselina...
Organska kemija je kemija ugljikovih spojeva, ali svi ugljikovi spojevi nisu organski spojevi – slažu se sve (mnogobrojne) definicije organske kemije. Zašto neki jesu, a drugi nisu? E, to je već malo teže pitanje, no meni je najjednostavniji, a ujedno i znanstveno najutemeljeniji odgovor da se u organskim spojevima, za razliku od anorganskih, ugljik nalazi u niskom oksidacijskom stanju, da je riječ – kako to kemičari, a posebice geokemičari vole reći – o „reduciranom ugljiku“. No da budem malo jasniji, ugljikov dioksid (CO2) je, razumije se, ugljikov spoj, ali nije organski spoj, poput metana, CH4. To je zato što je oksidacijski broj ugljika u CO2 jednak +4, a u metanu -4. Ili, drugim riječima, oksidacijom metana dobiva se ugljikov dioksid, a redukcijom ugljikova dioksida dobiva se metan, a – uz malo kemijanja – i drugi organski spojevi.
Ništa novo pod suncem: upravo to čine biljke kad pretvaraju CO2 u šećere, masti, bjelančevine, nukleinske kiseline, alkaloide, terpene, polifenole – i sve organske spojeve koje im trebaju. Stoga nije neobično da se već dugo radi na postupcima kojima bi se ugljikov dioksid mogao reducirati elektrolizom te tako pretvoriti u mnoge korisne produkte. (Redukcija je, prisjetimo se, primanje, a oksidacija otpuštanje elektrona.) No kako postići da CO2 primi elektrone drugo je pitanje. Kada se otopina ugljikova dioksida reducira, reducira se manje od dva posto CO2. Stoga se tehnološki postupak za elektrolitičku redukciju ugljikova dioksida jednostavno ne isplati.
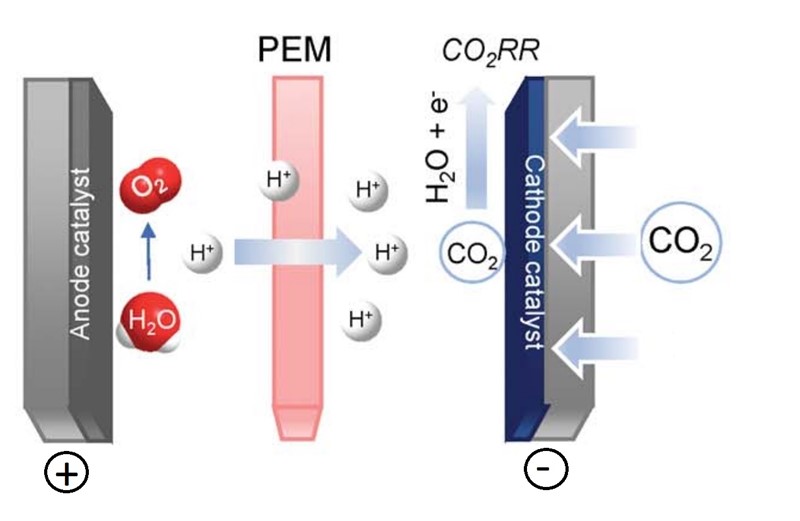
No, evo novog svjetla. Kanadski i australski znanstvenici nedavno su objavili u časopisu Science da su uspjeli elektrolizom reducirati 77 % ugljikova dioksida pretvorivši ga u CO2RR, što je kratica za sve produkte koji pritom nastaju. Pritom su uspjeli iskoristiti više od 50 % uložene energije. Kako je to moguće?
Odgovor nalazimo u naslovu znanstvenog rada, „CO2 electrolysis to multicarbon products in strong acid (Elektroliza CO2 u produkte s više ugljikovih atoma u jakoj kiselini)“. Najvažnije u naslovu je izraz „in strong acid“, jer su za razliku od drugih znanstvenika koji su elektrolizirali ugljikov dioksid u lužnatoj otopini, autori rada elektrolizirali CO2 u kiseloj sredini (pH < 1).
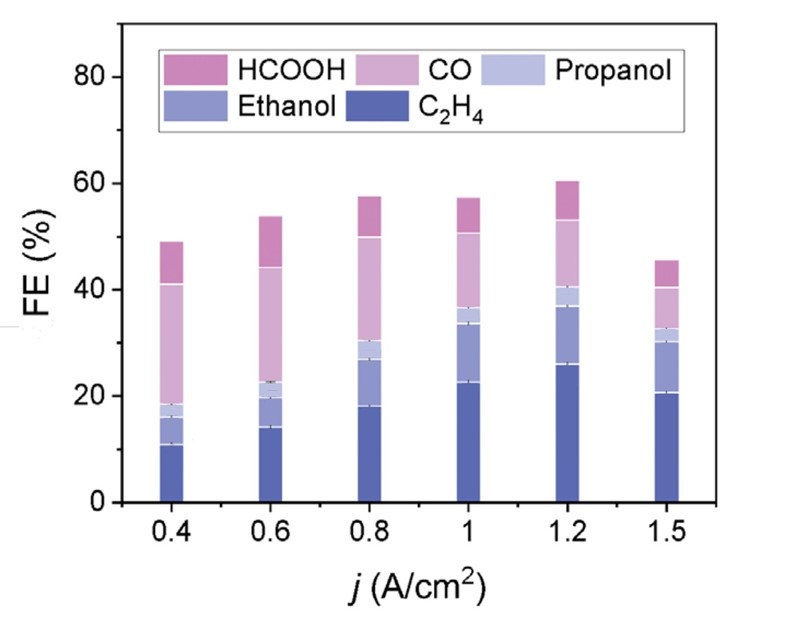
Riječ je o tome da se u lužnatoj otopini ugljikov dioksid nalazi u obliku karbonata, dakle u neaktivnom obliku, pa se pola energije troši samo na prevođenje karbonata u ugljikov dioksid. To je izbjegnuto upravo elektrolizom kisele otopine, u kojoj nema karbonata. I evo rezultata: ako je elektrolit fosforna kiselina kojoj je dodano nešto kalijevih soli, iz ugljikova se dioksida dobivaju organski spojevi s jednim, pa i više ugljikovih atoma. Od onih s jednim ugljikovim atomom tu je ugljikov monoksid (CO) i mravlja kiselina (HCOOH), a među onima s dva atoma je etan (C2H4) i etanol (C2H5OH). Usto nastaje i kemijski spoj sa tri ugljikova atoma, propanol (C3H7OH).
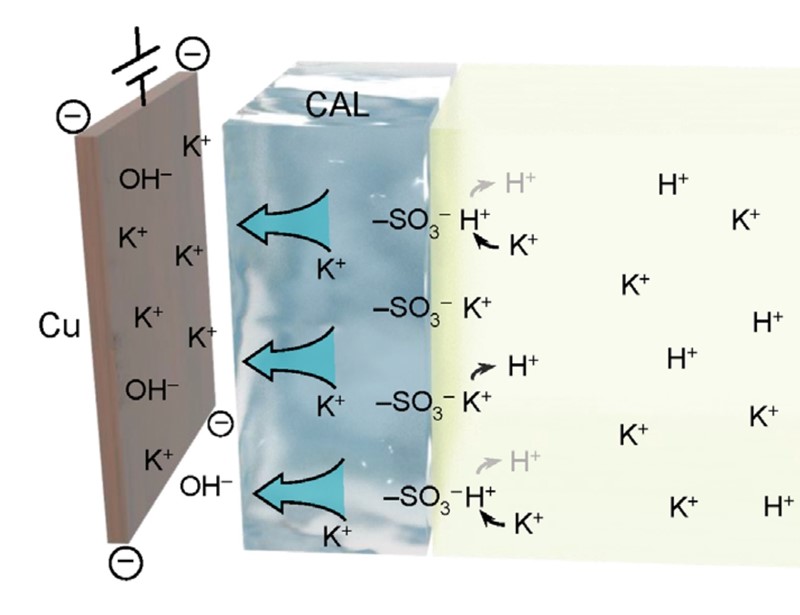
Kao i u svakom tehnološkom postupku uspjeh ovisi o mnogo faktora, da ne kažem sitnica, poput površine katode, brzine protoka elektrolita kroz ćeliju i gustoće struje. Površina bakrene katode presvučena je slojem za povećavanje koncentracije kationa (cation-augmenting layer, CAL). To je zapravo kationski izmjenjivač koji prema katodi propušta kalijeve, a zadržava vodikove ione kako se ne bi izlučivao vodik. Drugi faktor je gustoća struje (400 – 1500 mA/cm2). O njoj ne ovisi samo iskorištenje postupka (Faraday efficiency, FE) nego i sastav proizvoda: pri niskim gustoćama struje nastaje više spojeva s jednim, a pri višim gustoćama nastaje više produkata sa dva i više ugljikovih atoma.
Sve u svemu vrlo uspješan tehnološki postupak kojim će se za koju godinu, nadajmo se, ugljikov dioksid pretvariti u sirovine za kemijsku industriju. Sve u svemu nova nada za naš pregrijani planet: pokaže li uspješnim i u praksi, postupak kanadskih i australskih znanstvenika bit će još jedna tehnologija s nultom, pravo rečeno s negativnom emisijom ugljikova dioksida.

Nenad Raos, rođen 1951. u Zagrebu, je kemičar, doktor prirodnih znanosti i znanstveni savjetnik u trajnome zvanju, sada u mirovini. Autor je i koautor više od stotinu znanstvenih i stručnih radova iz područja bioanorganske i teorijske kemije, molekularnog modeliranja te povijesti kemije i komunikacijskih vještina u znanosti. Još od studentskih dana bavi se popularizacijom znanosti. Sedam je godina bio glavni i tehnički urednik časopisa Priroda, a danas je urednik rubrike Kemija u nastavi u časopisu Kemija u industriji. Koautor je dva sveučilišna udžbenika i autor 13 znanstveno-popularnih knjiga. Nagrađen je Državnom godišnjom nagradom za promidžbu i popularizaciju znanosti 2003. godine.
























