Atomski lanci: Koja je žica najčvršća?
Atom do atoma – i evo najtanje žice koja se uopće zamisliti može. Takvim se žicama već dugo bave znanstvenici, a sada – zahvaljujući metodama računalne kemije – znamo i njihova mehanička svojstva.
„The last tensile wires will simply be the chemical bonds.“ Posljednje zatezne žice bit će, jednostavno rečeno, kemijske veze. Tu rečenicu nije napisao kemičar nego arhitekt, Richard Buckminster Fuller, koji se proslavio izgradnjom geodetskih kupola. Arhitektura i kemija. I dalje od toga: svakom tko je učio kemiju jasno je da čvrstoća materijala na kraju ovisi o jakosti sila koje drže molekule i atome u njima na okupu. Kako su sile među atomima mnogo jače od sila među molekulama, materijal će biti to čvršći što je više sila među atomima, a to znači što ima veće molekule. Sile među atomima u molekuli ovise pak o čvrstoći kemijske (kovalentne) veze, koja se obično izražava u kilodžulima po molu (kJ/mol). To je energija koju treba utrošiti da bi se pokidao jedan mol, dakle Avogadrov broj (NA = 6,022·1023) kovalentnih veza.
Energija veze C-C, C=C, C≡N i mnogih drugih nije tajna, njihove se vrijednosti određuju još od 19. stoljeća jednostavnim kalorimetrijskim pokusom. No da bi se odredila mehanička svojstva molekula, najtanjih zateznih žica, treba imati nešto bolje od kalorimetrijske bombe, kako se popularno zove kalorimetar za spaljivanje uzoraka. To nešto bolje su metode računalne kemije. „The strongest and toughest predicted materials: linear atomc chains without Peierls instability (Najčvršći i najžilaviji predviđeni materijali: linearni atomski lanci bez Peierlsove nestabilnosti)“, naslov je rada kineskih znanstvenika objavljenog u časopisu Matter.
Zamisao je jednostavna: atome treba povezati u lanac kako bi se dobila žica, nit čija čvrstoća ne ovisi ni o čemu drugom nego o jakosti kemijskih veza kojima su atomi povezani. Toj žici treba potom izračunati mehanička svojstva, prije svega gravimetrijsku čvrstoću (prekidna sila podijeljena s linearnom gustoćom) te gravimetrijsku žilavost, energiju potrebnu za pucanje jednog grama materijala. Ima li takvih materijala?

Dakako da ima. Najpoznatiji linearni atomski lanci su lanci ugljikovih atoma, molekule u kojima su ugljikovi atomi povezani uzastopnim jednostrukim i trostrukim vezama, -C≡C-C≡C-. Takve molekule, karbine, nije teško proizvesti u laboratoriju, a nadasve su zanimljive jer su otkrivene i u međuzvjezdanom prostoru. (Buckminsterfulleren – nova alotropska modifikacija ugljika, C60, koja je dobila ime upravo po arhitektu spomenutom na početku članka – otkrivena je baš pri istraživanju karbina.) Njihova gravimetrijska čvrstoća, pokazuju proračuni kineskih znanstvenika, iznosi 76,4 GPa g-1 cm3, a gravimetrijska žilavost 9,4 kJ/g – što je 120 puta više od kevlara (0,078 kJ/g)! Čak se ni grafen, „najčvršći materijal na svijetu“, ne može mjeriti s karbinima, jer on ima gravimetrijsku čvrstoću od „samo“ 50,6 GPa g-1 cm3.
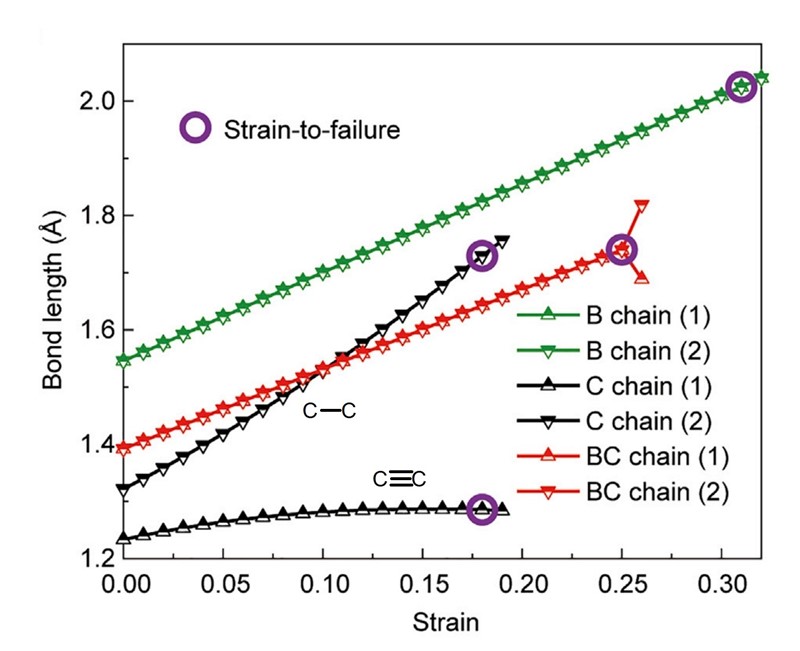
I sve bi bilo dobro da bolje ne može biti da nije jednog velikog ali, a taj „ali“ vidimo već u naslovu spomenutog znanstvenog članka, u izrazu „Peierlsova nestabilnost“. Zbog te pojave, Peierlsove nestabilnosti, molekule karbina ne mogu izdržati veća naprezanja, linearna istezanja, a napose savijanja. Temeljni uzrok te pojave je u tome što veze koje povezuju ugljikove atome nisu jednake: neki su ugljikovi atomi povezani jednostrukim, a drugi trostrukim vezama. I ne samo to. Karbini su vrlo reaktivni, pa je teško zamisliti njihovu primjenu u tehnici.

Gdje je rješenje? Rješenje je dakako u linearnim lančanim molekulama u kojima su svi atomi bili povezani istom vrstom kovalentne veze. To su molekule bora, B, i borova karbida, BC. U njima su svi atomi povezani istom vezom, vezom B=B i u molekuli B i vezom B=C u molekuli BC. Zahvaljujući tome u molekulama B i BC nema Peierlsove nestabilnosti. Štoviše, po mehaničkim svojstvima B i BC nadmašuju ne samo karbine nego i sve druge materijale. Lanci BC imaju najveću poznatu gravimetrijsku čvrstoću (91,8 GPa g-1 cm3 ), dok lanci borovih atoma imaju najveću zabilježenu gravimetrijsku žilavost (16,9 kJ/g) – 1,8 puta veću do žilavosti karbina, i čak 200 puta veću od žilavosti kevlara.
Tako kaže teorija. Ona kaže koliko su čvrsti molekulski lanci, no ne kaže ništa o tome kako bi ih trebalo pripraviti. Taj je posao prepustila eksperimentalcima. Može li se to? Najduži karbin, dug preko 6000 atoma (> 0,4 µm), priređen je sintezom u ugljikovoj nanocjevčici. Na taj bi se način, smatraju autori spomenutog rada, mogli prirediti i linearni lanci B i BC.

Nenad Raos je kemičar, znanstveni savjetnik u trajnome zvanju, koji je radio do umirovljenja 2016. godine u zagrebačkom Institutu za medicinska istraživanja i medicinu rada (IMI). Autor je i koautor oko 200 znanstvenih i stručnih radova iz područja teorijske (računalne) kemije, kemije kompleksnih spojeva, bioanorganske kemije i povijesti znanosti. Bio je pročelnik Sekcije za izobrazbu Hrvatskog kemijskog društva, glavni urednik Prirode te urednik rubrike Kemija u nastavi u časopisu Kemija u industriji. Još od studentskih dana bavi se popularizacijom znanosti. Autor je oko 3000 znanstveno-popularnih članaka te 14 znanstveno-popularnih knjiga.















