Biodizel uklanja CO2
Što se krije iza ovog čudnog naslova? Krije se nova metoda za iskorištavanje ugljikova dioksida temeljena na usklađenom radu dvije katalizirane reakcije.

Čitatelj se čudi i s pravom pita: „Kako je moguće da biodizel uklanja ugljikov dioksid kad njegovim izgaranjem nastaje upravo ugljikov dioksid?“ To se opire osnovnoj kemijskoj logici da ne kažemo faktičnoj istini: potpunim izgaranjem metilnih estera masnih kiselina (biodizel je upravo to po kemijskom sastavu) ne može nastati ništa drugo osim CO2 i H2O. Nepotpunim izgaranjem, izgaranjem bez dovoljno kisika (zraka) može, istina, nastati mnogo čega – od ugljikova monoksida do polikličkih aromatskih ugljikovodika („čađe“) i ugljena – ali kako god da uzmeš, spomenuti esteri ne mogu se spajati s ugljikovim dioksidom, iz zraka ili iz bilo čega drugog.
Sve je to točno, samo smo na tvrdnju iz naslova postavili krivo pitanje. Pitali smo se naime „Uklanja li izgaranje (potrošnja) biodizela CO2?“, umjesto da smo se pitali „Može li proizvodnja biodizela ukloniti CO2?“ Riječ je dakle o krivo ili, bolje rečeno, nedovoljno precizno postavljenom pitanju. No vratimo se od skolastike na kemiju.
Kao što je već iz druge rečenice ovog članka jasno, biodizel nije naprosto jestivo ulje (izravno proizvedeno ili otpadno) uliveno u motor s unutrašnjim izgaranjem bez svjećica. Da bi se od biljnog ulja proizvelo plinsko ulje treba ga transesterificirati, što je stručni termin za prevođenje estera glicerola u estere metanola. Glicerol je trovalentni alkohol, formule HOCH2-CH(OH)-CH2OH, sustavnog imena propan-1,2,3-triol. On za sebe veže tri molekule masnih kiselina čija je opća formula R-COOH, gdje R stoji za ugljikovodični nerazgranati lanac s više, jednom ili nijednom dvostrukom vezom. U procesu transesterifikacije dolazi do odvanjanja glicerola od masnih kiselina te njihovim spajanjem s drugim alkoholima, u ovom slučaju metanolom, CH3OH. No u tom procesu, jasno je, uz nove estere nastaje i glicerol. On je dakle nužan nusprodukt rečenog tehnološkog postupka. Što s njime činiti?
Odgovor na to pitanje nudi ove godine objavljeno istraživanje indijskih i njemačkih znanstvenika obljavljeno u časopisu Advanced Functional Materials: „Boosting the simultaneous conversion of glycerol and CO2 to lactatate and formate using ZrO2-supported NiO catalyst“. O čemu je riječ?
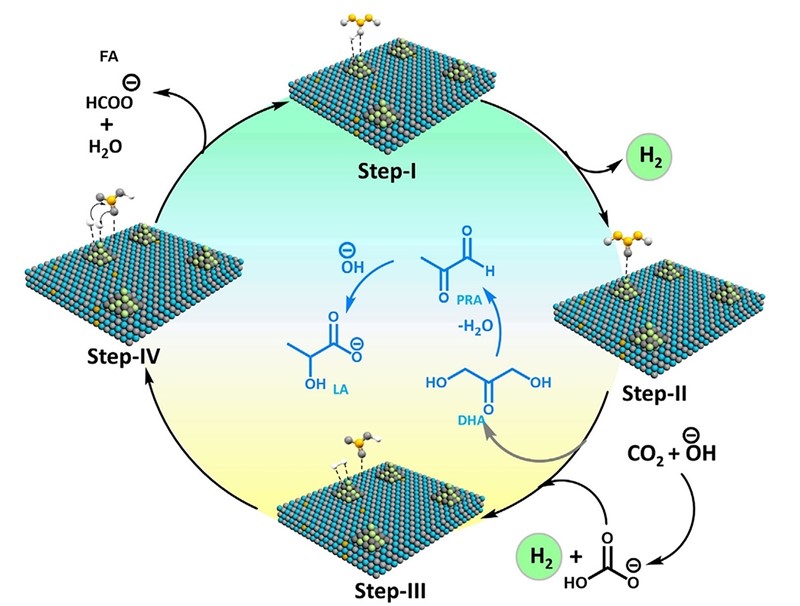
Riječ je kao prvo o novom katalizatoru na bazi cirkonijeva oksida (ZrO2) s dodatkom 10 % niklova oksida (NiO) koji, kako piše u naslovu, katalizira dvije nezavisne reakcije („simultaneous conversion“). U prvoj se reakciji glicerol oksidira na keton DHA koji se potom uz gubitak vode prevodi u ketoaldehid PRA i na kraju, adicijom hidroksilnog ona (OH-) u mliječnu kiselinu, CH3CH(OH)COOH (LA). No najvažnije u toj reakciji je što se u njoj oslobađa vodik u plinovitom, elementarnom stanju (H2) koji potom služi, u trećem katalitičkom procesu, za redukciju ugljikova dioksida u mravlju (metansku) kiselinu, HCOOH (FA).
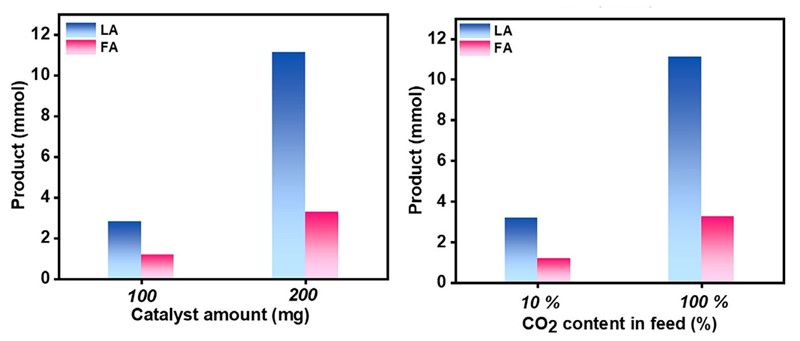
Ljubiteljima kemijskih reakcija i formula možda je sada sve jasno, no problem nije u kompliciranosti reakcija nego u njihovoj usklađenosti, a još više o uvjetima u kojima se one odvijaju. To upravo pokazuje navedeno istraživanje u kojem je iskušano sedam uvjeta katalizirane reakcije ugljikova dioksida i glicerola. Koliko su uvjeti bitni najbolje će nam pokazati podatak da se pri najlošijim uvjetima jedva 1,3 % glicerola prevelo u mliječnu kiselinu, dok se pri najboljim uvjetima taj udio povisio na 56 %. Istodobno, iscrpak mravlje kiseline se povećao 14 puta. To je ostvareno u kalijevoj lužini pri tlaku CO2 od 40 bara i temperaturi od 200 oC.
Da nije sve ostalo na pukoj teoriji, vidimo iz završnog dijela spomenutog rada u kojem su njegovi autori napravili provizornu tehnološku analizu opisanog postupka. Dakle, tvornica bi godišnje proizvodila 250 tisuća tona mliječne i 111 tisuća tona mravlje kiseline i pri tome bi – što je najvažnije – trošila 143 tisuća tona CO2. Proizvodnja bi se isplatila, kažu proračuni, dajući umjereni profit. Odakle profit? Naravno, iz proizvodnje spomenute dvije kiseline: mravlja kiselina se koristi u poljoprivredi i prehrambenoj industriji, a može poslužiti i u proizvodnji goriva, dok se mliječna kiselina može polimerizirati u biorazgradivu plastiku.

Nenad Raos je kemičar, znanstveni savjetnik u trajnome zvanju, koji je radio do umirovljenja 2016. godine u zagrebačkom Institutu za medicinska istraživanja i medicinu rada (IMI). Autor je i koautor oko 200 znanstvenih i stručnih radova iz područja teorijske (računalne) kemije, kemije kompleksnih spojeva, bioanorganske kemije i povijesti znanosti. Bio je pročelnik Sekcije za izobrazbu Hrvatskog kemijskog društva, glavni urednik Prirode te urednik rubrike Kemija u nastavi u časopisu Kemija u industriji. Još od studentskih dana bavi se popularizacijom znanosti. Autor je oko 3000 znanstveno-popularnih članaka te 16 znanstveno-popularnih knjiga; posljednja je "Antologija hrvatske popularizacije prirodnih znanosti".



















