Ima li klora u vodi? Ne pitaj svoj nos nego svoj mobitel!
Oni koji se boje klora u vodi ili vodu sami kloriraju sada će moći sami vidjeti koliko ga ima. Za to će im trebati UV-lampa, smartfon i kemijski reagens priređen od rakova oklopa.

Klor je vrag. Klor je bio prvi bojni otrov: upotrijebili su ga Nijemci u Prvom svjetskom ratu. Klor je, kažem, vrag, ali vrag bez kojeg se ne može. Nema boljeg dezinfekcijskog sredstva od klora. Otapanjem plinovitog klora, Cl2, u vodi dobiva se klorna voda, koja po kemijskom sastavu odgovara razrijeđenoj hipoklorastoj kiselini, HClO. No hipoklorasta kiselina je nestabilna, pa se radije koristi njezina natrijeva sol, natrijev hipoklorit (NaClO) čija se koncentrirana otopina (27 %) bez ikakva problema, koji inače prate kupovinu kemikalija, može kupiti u svakoj trgovini mješovite robe pod imenom Varekina, Varikina, Cekina i slično. Čudno. Kažem „čudno“ jer se reakcijom te otopine sa solnom kiselinom, HCl, koja se isto tako može slobodno kupovati, dobiva klor – dakle bojni otrov. Nitko nije, nadam se, toliko lud da to namjerno čini, no mnogima se dogodilo da zbog neznanja kemije upravo to naprave i pri tome pretvore kupaonicu u plinsku komoru. (Dozvoljena koncentracija klora u zraku iznosi samo 1 mg/m3.)
No i bez klora klor je opasan. Nije naime samo otrovan elementarni, plinoviti klor nego i hipokloriti, posebice u vodi za piće. Oni mogu izazvati astmu, upalu grla te prouzročiti povraćanje. Dvojaka narav klora vidi se i u našem tijelu. Vrsta zaštitnih stanica, polinuklearni neutralofilni leukociti uništavaju štetne mikrobe upravo lučenjem hipokloraste kiseline, no čineći to štete ne samo neželjenim gostima nego i samom organizmu izazivajući mutacije (koje na kraju dovode do nastanka raka), a pokazalo se da utječu i na nastanak bolesti bubrega, Alzheimerove i drugih neurodegenerativnih bolesti, a usto i dijabetesa, kardiovaskularnih bolesti i reumatoidnog artritisa. Kako je to moguće? Moguće je zato jer je klor – i, dakako, njegovi spojevi – jako oksidacijsko sredstvo koja ne bira što će oksidirati. A kada se „sve“ oksidira, onda se i „sve“ poremeti – pa ne nastaje jedna, nego mnoštvo bolesti.
Kako se i voda za piće (iz vodovoda) klorira, ima dosta ljudi koji ne piju vodu osim ako je flaširana ili je pak sami ne zagrabe sa izvora. No takvi bi prije nego što se upuste u pijenje flaširane vode (koja je, osim što je skupa, onečišćena mikroplastikom) bilo bolje da znaju imaju li razloga za strah, naime da ustanove ima li ili nema klora u vodi koju namjeravaju piti.
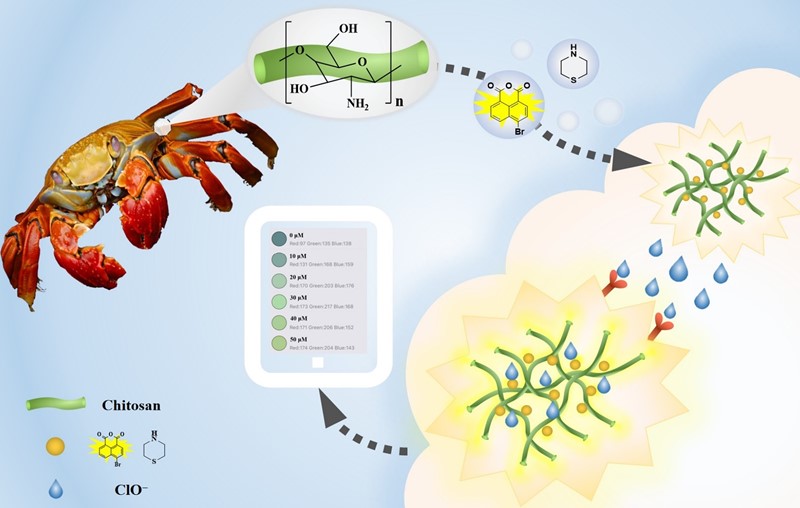
Upravo za takve, s pravom ili nepravom oprezne ljude, kineski su znanstvenici napravili jednostavan tekst na klor – koji se može izvesti mobitelom! U članku „A chitosan-based fluorescent probe combined with smartphone technology for the detection of hypochlorite in pure water“, objavljenom u časopisu Molecules, opisali su takav test. Za njega osim mobitela treba imati UV-lampu valne duljine 336 nm, a usto i njihov reagens – napravljen od rakova oklopa.
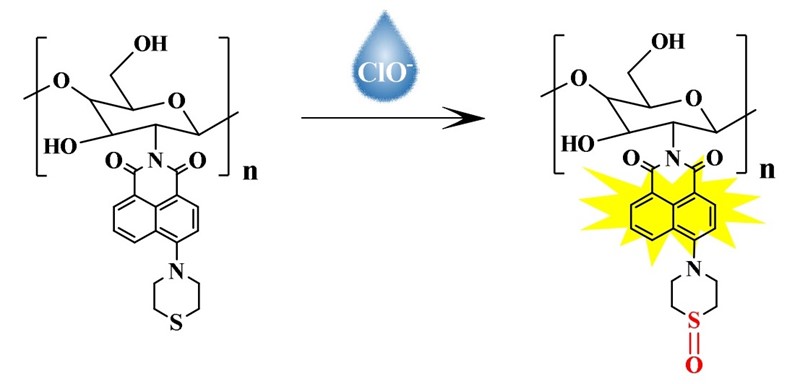
Rakov se oklop krije u naslovu, u sintagmi „a chitosan-based probe“. Kitozan (chitosan) je naime materijal proizveden od hitina (dosta jednostavno: kuhanjem s natrijevom lužinom), a hitin je pak glavni sastojak rakova oklopa, no i ljušture drugih člankonožaca. Riječ je o polisaharidu, dakle celulozi sličnoj tvari, koji nakon obrade natrijevom lužinom gubi acetilne skupine i prelazi u kitozan (CS) – polimerni lanac iz kojeg vire hidroksilne (-OH) i amino (-NH2) skupine. Kada se na amino skupine veže anhidrid 4-bromnaftalen-1,8-dikarboksilne kiseline, a zatim tiomorfolin, dobiva se konačni produkt CS-BNS. Taj kemijski spoj ima složenu strukturu no jednostavno djelovanje: ako se na njega kapne otopina koja sadrži hipoklorite, on će se oksidirati na sumporu, pa će pod UV-lampom promijeniti boju iz tirkizne (zelenoplave) u žutu (λ = 494 nm).

Promjena boje može se zamijetiti prostim okom – no to je samo dokaz da u vodi ima hipoklorita. Za kvantitativnu analizu trebat će nam spekrofotometar. Takvim uređajem mogu se detektirati hipokloriti već u koncentraciji od 0,27 μmol/L (14 ppb). No mi toga nemamo, ali imamo uređaj koji se spominje u naslovu rečenoga rada. Riječ je dakako o pametnom mobitelu (smartphone). On nam ne daje puni spektar uzorka nego samo omjer intenziteta crvene (R) i plave (B) boje u njemu. Unatoč takvoj, primitivnoj metodi mjerenja, njime se mogu dobiti vrlo pouzdani rezultati, no uz povišenje praga detekcije na 4,1 μmol/L (215 ppb). No to mnogo ne smeta budući da koncentracija hipoklorita u vodi za piće ne smije biti veća od 0,5 mg/L, dakle 500 ppb.

Nenad Raos je kemičar, znanstveni savjetnik u trajnome zvanju, koji je radio do umirovljenja 2016. godine u zagrebačkom Institutu za medicinska istraživanja i medicinu rada (IMI). Autor je i koautor oko 200 znanstvenih i stručnih radova iz područja teorijske (računalne) kemije, kemije kompleksnih spojeva, bioanorganske kemije, povijesti kemije i komunikacijskih vještina u znanosti. Bio je pročelnik Sekcije za izobrazbu Hrvatskog kemijskog društva, glavni urednik Prirode te urednik rubrike Kemija u nastavi u časopisu Kemija u industriji; član je društva ProGeo-Hrvatska i Odjela za prirodoslovlje i matematiku Matice hrvatske. Još od studentskih dana bavi se popularizacijom znanosti. Autor je 15 znanstveno-popularnih knjiga, posljednja je „„Kemičar u kući – kemija svakodnevnog života“.















