Nobelom ovjenčani „popravljač gena“ CRISPR/Cas9 ublažava simptome autizma u miševa
Zapakiran u nanočestice zlata i s manje nuspojava od infekcije laboratorijskim virusom-nosačem, CRISPR/Cas9 u dubokim regijama mozga uspijeva popraviti oštećenje gena odgovornog za simptome autizma u miševa
Autizam (poremećaj iz autističnog spektra, autism spectrum disorder, ASD) je skupina složenih neurorazvojnih poremećaja koji su uglavnom karakterizirani poremećenim socijalnim funkcioniranjem i ograničenim opsegom komunikacije. Simptomi mogu uključivati intenzivnu usredotočenost na jednu aktivnost, izostanak odaziva pri pokušaju uspostave komunikacije, nerazumijevanje komunikacijskih znakova (npr. intonacije glasa ili govora tijela), te stereotipno ponavljajuće pokrete (repetitivno njihanje tijelom, mahanje rukama ili čak nasilno ponašanje prema sebi, poput udaranja glavom u predmete). Jačina simptoma uvelike varira među pojedinim osobama. Ostali mogući simptomi uključuju relativno kasan razvoj govora, nedostatak interaktivnosti u igri s drugom djecom, izbjegavanje kontakta očima, nedostatak empatije i socijalno povlačenje.
Genetika i okoliš u interakciji
Često se postavlja pitanje što je uzrok autizma. Ne postoji jedan uzrok: istraživanja sugeriraju da se autizam razvija iz kombinacije genetskih (prirođenih) i negenetskih (okolišnih) utjecaja. Pritom valja istaknuti kako nijedan od tih utjecaja nije neposredan uzrok autizmu: kaže se da genetski i okolišni utjecaji povećavaju rizik za pojavu autizma. Pritom valja stalno imati na umu kako povećani rizik nije isto što i uzročni čimbenik.

Primjerice, neke genetske anomalije koje se nalaze u osoba s autizmom mogu se naći i kod ljudi koji nemaju taj poremećaj. Slično tome, svi koji su izloženi okolišnim faktorima rizika za autizam neće razviti autistični poremećaj; točnije rečeno, većina izloženih ga neće razviti.
Ako gledamo genetiku kao potencijalni uzročni faktor, činjenica je da se autizam češće (ali ne i isključivo) javlja unutar pojedinih obitelji. Promjene u nekim genima povećavaju rizik da se kod djeteta dijagnosticira autizam. Ako roditelj (koji sâm nema nikakve znakove autističnog poremećaja) u svojim genima nosi jednu ili više od ovih promjena, one se mogu se prenijeti na dijete. O genima koji su povezani s autizmom već smo pisali na ovom portalu.
Rani razvoj mozga, predispozicija i rizični čimbenici
No, s druge strane, te genetske promjene ne moraju biti naslijeđene, već mogu nastati same od sebe, spontano, u spermiju i / ili jajašcu koji se kombiniraju u stvaranju embrija ili u ranima fazama razvoja embrija. I opet, većina ovih promjena gena sama po sebi ne uzrokuje autizam, nego povećavaju rizik za nastanak autističnog poremećaja. Za osobe koje su nositelji gena koji povećavaju taj rizik, kažemo da su genetski predisponirani za nastanak autizma.

Istraživanja također pokazuju da određeni utjecaji iz okoline mogu dodatno povećati - ili smanjiti - rizik od autizma kod ljudi koji su genetski predisponirani za ovaj poremećaj. Rizik je povećan ako je bilo koji od roditelja visoke životne dobi, ako su trudnoća ili porod bili komplicirani (npr. ekstremna nedonošenost, mala porođajna težina, višeplodne trudnoće - blizanci, trojke, itd.), uzastopne trudnoće u razmaku manjem od godinu dana. Smanjen rizik opažen je ukoliko se prije začeća i tijekom trudnoće uzimaju prenatalni vitamini koji sadrže folnu kiselinu.

Zasebna priča (koja nije ni zaslužila biti zasebna) su cjepiva. Svaka obitelj ima jedinstveno iskustvo s dijagnozom autizma njihovog djeteta, posebice stoga što je u neke djece vrijeme prepoznavanja prvih simptoma i postavljanja dijagnoze koincidentno vremenu kada se provodi kalendar cijepljenja. Znanstvenici su tijekom posljednja dva desetljeća proveli opsežna istraživanja kako bi utvrdili postoji li kakva veza između cijepljenja u djetinjstvu i pojave autizma. Rezultati istraživanja su nedvojbeni i jasni: cjepiva ne uzrokuju autizam. Američka Akademija za pedijatriju (AAP) sastavila je opsežan popis tih istraživanja.
Čini se da većina rizičnih čimbenika utječe na ključne aspekte ranog razvoja mozga, a posebice na procese uzajamne komunikacije moždanih živčanih stanica (neurona) koja je neophodan preduvjet pravilnog razvoja živčanog sustava. Neki od tih procesa utječu na procese međusobne komunikacije čitavih regija mozga.
Nobel za enzimske DNA-škare
Trenutno postoji nekolicina velikih istraživanja koja proučavaju razvojne moždane procese i genetske poremećaje koji do njih dovode, a u cilju iznalaženje mogućnosti liječenja i potpornih mjera koje mogu poboljšati kvalitetu života osoba s poremećajima iz autističnog spektra.
Rezultati jednog od takvih istraživanja objavljeni su u časopisu Nature Biomedical Engineering, a ovih dana su došli u fokus znanstvene i medijske pozornosti jer koriste tehniku editiranja gena nazvanu CRISPR/Cas9, za čije otkriće i razvoj je upravo dodijeljena Nobelova nagrada za kemiju 2020. dvjema znanstvenicama, Francuskinji Emmanuelle Charpentier i Amerikanki Jennifer Doudna.
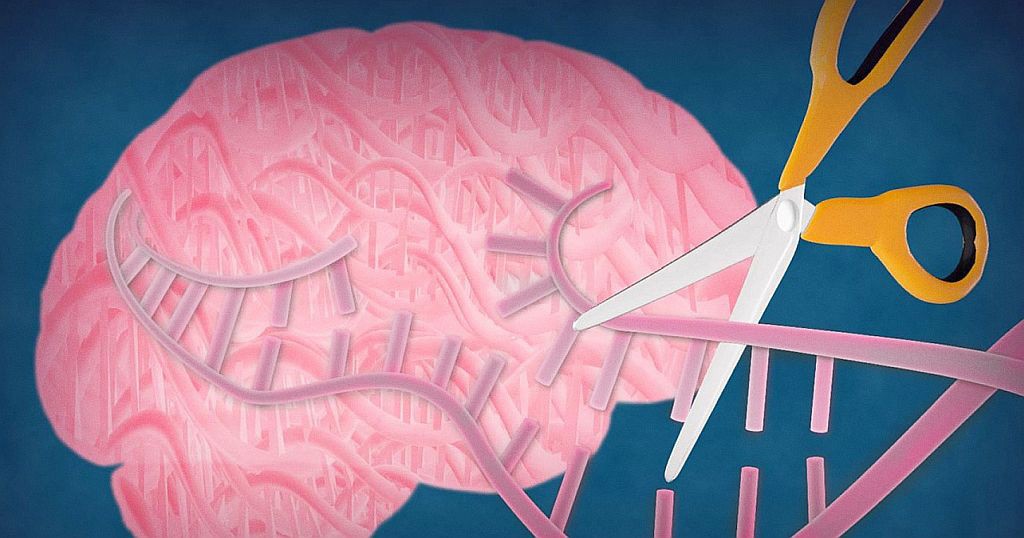
CRISPR/Cas9 je tehnologija koja se koristi za „popravak“ mutiranih gena povezanih s pojavom nekih bolesti. Ona je isprva otkrivena kao prirodni dio imunološkog sustava bakterije Streptococcus pyogenes kojim se ta bakterija bori protiv pokušaja napadača, virusa-bakteriofaga, da ugradi dijelove svojih gena u bakterijski DNA i prisili bakteriju na proizvodnju novih virusa.

U osnovi, Cas9 je enzim koji djeluje poput molekularnih škara: sposoban je prerezati lanac DNA na točno određenim mjestima koja se skraćeno nazivaju CRISPR. Da bi Cas9 došao na točno mjesto gdje će izrezati neželjeni CRISPR-dio lanca DNA, brine se RNA-vodič po imenu tracRNA.
Ovaj proces rezanja i popravljanja DNA je univerzalan u živome svijetu: iako je u bakterijama prvi puta otkriven i opisan, ne događa se samo u njima, već je dio prirodnog procesa „popravljanja grešaka“ na DNA u svim živućim, fukcionalnim stanicama.
Problematičan unos u moždane stanice
Dakle, ukoliko se u laboratoriju koristi tracRNA-vodič koji je dizajniran za točno određeni CRISPR dio lanca (npr. dio koji u sebi sadrži nepoželjni, mutirani gen), tada će Cas9 precizno izrezati taj dio DNA-sekvence, a normalni stanični mehanizmi popravka će taj izrezani dio zamijeniti ispravnim. Ukratko, CRISPR/Cas9 je tehnologija editiranja gena koja je pored ostalog sposobna iz živih stanica selektivno izrezati dijelove DNA koji uzrokuju simptome nekih genetski uzrokovanih bolesti.
Međutim, unatoč golemom potencijalu CRISPR/Cas9, znanstvenici i dalje pokušavaju odrediti najbolji način za unošenje te tehnologije u različita tjelesna tkiva. Konkretno, vrlo je teško i komplicirano učinkovito „ubaciti“ i pokrenuti CRISPR/Cas9 u mozgu žive jedinke, a da to ne uzrokuje toksične nuspojave.
Donedavno je najbolji način unošenja CRISPR/Cas9 u mozak bio „virusna isporuka“, u kojoj se kao nosač koristio neki od inaktiviranih virusa sposobnih prodrijeti kroz inače teško prolaznu krvno-moždanu barijeru, ući u stanice mozga, te u njihovoj jezgri na ciljani dio DNA „isprazniti“ svoj teret: Cas9 i tracRNA. No, „virusna tehnika“ ima nekoliko bitnih ograničenja, od kojih su najznačajnije imunološke reakcije koje tijelo može pokrenuti protiv virusa-nosača. U pokušajima izbjegavanja takvih komplikacija, istraživači se sve više usmjeravaju na razvoj nevirusnih metoda za unošenje CRISPR/Cas9 vođenog tracRNA-vodičem u mozak.
Fragilni X-kromosom za autizam u ljudi i miševa
Ukoliko se tehnika usavrši, jedna od bolesti u kojoj bi se CRISPR/Cas9 mogao koristiti za liječenje je sindrom fragilnog X-kromosoma (fraX-sindrom), kojega karakterizira umjereni do teži stupanj neurorazvojnih poremećaja od kojih se velik dio nalazi unutar autističnog spektra. Taj sindrom se stoga smatra najčešćim monogenskim uzrokom autizma u ljudi, a opažen je i kod specijalnih sojeva laboratorijskih miševa.

Postoji nekoliko gena za koje istraživači smatraju da su dobar cilj za CRISPR/Cas9-liječenje fraX-sindroma. Jedan od njih naziva se mGluR5, a dokazano je povezan ne samo s fragilnim X-kromosomom, već i s drugim poremećajima iz autističnog spektra (ASD). Istraživači su nagađali da bi „popravak“ mGluR5-gena moglo ublažiti simptome autizma kod osoba s krhkim X-kromosomom i drugim poremećajima iz spektra.
Dosadašnji pokusi provedeni su na sojevima laboratorijskih miševa koji imaju sindrom fragilnog X-kromosoma i zbog toga pokazuju tipične znakove poremećaja iz autističnog spektra: pretjerano stereotipno (ponavljajuće) ponašanje i izostanak normalnih socijalizacijskih aktivnosti. No, istraživači su umjesto tehnike virusnog nosača koristili nanočestice zlata dizajnirane i izrađene u laboratorijima Sveučlišta Berkeley kako bi u mozak miševa unijeli Cas9 enzim (DNA „škare“).
Izrezivanjem dijela X-kromosoma koji na sebi nosi gensko oštećenje, istraživači su uspjeli editirati mGluR5 gen u stanicama mišjeg mozga, a posljedica te genske intervencije bila je značajno smanjenje autističnih simptoma (repetitivnog ponašanja) miševa. Reduciranje takvih ponavljajućih radnji tipičnih za kliničku sliku poremećaja iz autističnog spektra kod laboratorijskih fraX-miševa demonstracija je potencijala za terapijske intervencije koje ima CRISPR/Cas9 metoda i na drugim oblicima autističnih poremećaja za koje je poznat genetički uzrok.
CRISPR-Gold za ulazak u corpus striatum
Ova tehnika koja kombinira CRISPR/Cas9 i zlatne nanočestice – prigodno nazvana CRISPR-Gold – ima mnoge prednosti ispred nekih drugih metoda koje se zadnjih godina koriste za genetičke intervencije Znanstvenici su pokazali da injiciranjem CRISPR-Golda u mozak moguće „izrezati“ oštećeni gen i potom klinički registrirati signifikantno poboljšanje koje dokazuje da je takvo „nokautiranje“ patološkog gena isključilo uzročnu osnovu nastanka poremećaja.
„CRISPR-Gold je nakon intrakranijalne injekcije uspio u corpus striatumu inhibirati 40-50% mGluR5-a, uzročnog gena za autizam“, stoji u zaključcima i tumačenju rezultata tog rada.
„Kod miševa liječenih mGluR5 – CRISPR-Gold metodom nije opažen pojačan imunološki odgovor na injicirani lijek, što je bio redovit problem kod korištenja virusnog nosača, a kod miševa je opaženo značajno smanjenje stereotipija i autističnog ponašanja.“
„Naši rezultati pokazuju da uređivanje gena putem nevirusne isporuke CRISPR-a u lokalnu regiju mozga može trajno korigirati autistične obrasce ponašanja u miševa s autizmom. CRISPR-Gold tehnika ima značajan potencijal u osmišljavanju novih metoda genetske terapije ciljanih dijelova mozga“, izjavili su prigodom prezentacije rezultata rada.

Igor „Doc“ Berecki je pedijatar-intenzivist na Odjelu intenzivnog liječenja djece Klinike za pedijatriju KBC Osijek. Od posla se opušta antistresnim aktivnostima: od pisanja svojevremeno popularnih tekstova i ilustracija u tiskanom izdanju časopisa BUG, crtkanja grafika i dizajna, zbrinjavanja pasa i mačaka, te fejsbučkog blogiranja o craft-pivima, životnim neistinama i medicinskim trivijama, sve do pasioniranog kuhanja posve probavljivih jela i sviranja slabo probavljivog bluesa.















