Molekulska čaša hvata CO2 iz zraka
Kaliksareni su organski spojevi čija molekula sliči na kalež, na čašu. Evo jednog novog: on lako veže ugljikov dioksid i još ga lakše otpušta.

Nedavno je kroz medije prohujala senzacionalna vijest o brodu na fosilna goriva koji ne ispušta ugljikov dioksid. Senzacija – mo'š mislit! Riječ je tome (da objasnim i opravdam svoje snebivanje) da dim iz motora, umjesto u dimnjak, ulazi u prostoriju u kojoj se nalazi živo vapno, tj. kalcijev oksid (CaO). Da gašeno vapno, kalcijev hidroksid, Ca(OH)2, veže ugljikov dioksid znamo svi: to smo vidjeli u školi kada smo puhali u vapnenu vodu koja se potom zamutila. Zamutila se dakako od kalcijeva karbonata, CaCO3, koji je nastao reakcijom kalcijeva hidroksida i ugljikova dioksida. Slična se reakcija dešava i s kalcijevim oksidom (CaO + CO2 → CaCO3). Ta druga reakcija povoljnija je od prve jer je jednostavnija: za vezanje iste količine plina troši se manje živog nego gašenog vapna, a usto se u reakciji ne oslobađa voda pa ne treba ništa sušiti. Sve je to lijepo, bajno i sjajno, dok se ne dođe do pitanja kako se dobiva sredstvo za vezanje tog stakleničkog plina, živo vapno ili kalcijev oksid.
Živo vapno dobiva se prženjem („pečenjem“) vapnenca, dakle suprotnom reakcijom od reakcije vezanja ugljikova dioksida (CaCO3 → CaO + CO2). To znači da je vezano upravo onoliko ugljikova dioksida iz dima koliko ga je ispušteno u zrak pri proizvodnji živog vapna. Istina, kalcijev karbonat nastao u pročistaču plinova se može regeneritati, no njegova regeneracija ne može biti drugo nego pečenje vapna. A za pečenje vapna treba utrošiti energiju, toplinu (najmanje 4,0 MJ ili 1,1 kWh po kilogramu vezanog CO2). Još gore, kako se proces odvija pri visokom temperaturama (900 – 1000 oC), za njega nije moguće iskoristiti otpadnu toplinu. Konačni rezultat: motor bez ispušnih plinova troši više energije.
Tu leži osnovni problem dobivanja ugljikova dioksida iz otpadnih plinova, a još više iz zraka (u kojem ga ima samo 0,04 %). Lako ga je uhvatiti, ali je teško zatvoriti tehnološki proces. Regeneriranje sredstva (reagensa) za hvatanje CO2 je skupo u pogledu utroška energije, za što je najbolji primjer upravo opisan slučaj broda na fosilna goriva bez dimnjaka.

Dakako, sve se ne završava na osnovnoškolskoj, da ne kažem zidarskoj kemiji. Tome svjedoči i znanstveni rad britanske kemičarke i njezina arapskog kolege objavljen u časopisu Molecules: „Anion complexation by an azocalix[4]arene derivative and the scope of its fluoride complex salt to capture CO2 from the air“. Eh, kaliksareni! Kad sam prvi put za njih čuo (a davno sam čuo jer se tim spojevima bave i naši kemičari), začudio sam se kakve sve oblike molekule mogu imati. Jer kaliksareni su spojevi čije molekule nalikuju na čašu: broj 4 u imenu spomenutog kaliksarena (azokaliks[4]aren, CA-AZ) znači su u njegovoj molekuli četiri manje molekule vezane u prsten, bolje reći u oblik čaše (lat. calix – čaša, pehar, zdjela). Što je to posebno u novom kaliksarenu, kaliksarenu koji može – piše u naslovu – hvatati ugljikov dioksid iz zraka („capture CO2 from the air“)?
Pogledamo li naime grozomornu formulu kaliksarena CA-AZ (kojoj je na slici prikazana samo jedna četvrtina) primijetit ćemo hidroksilnu (-OH) skupinu vezanu za aromatski (šesteročlani) prsten. Ta hidroksilna, točnije fenolna skupina otpušta vodikov ion (H+) koji se potom veže za atom dušika. Uslijed toga gornji se dio molekule nabija pozitivno, pa veže za sebe negativno nabijene ione, anione. U rečenom znanstvenom radu istraženo je vezanje pet aniona – klorida (Cl-), fluorida (F-), hidrogensulfata (HSO4-), dihidrogenfosfata (H2PO4-) – i, najvažnije, karbonata (CO32-), aniona ugljične kiseline.
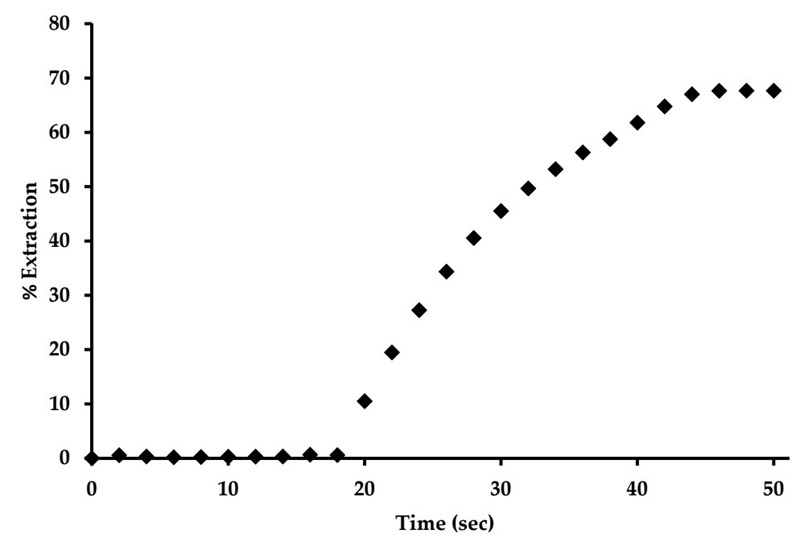
Da se nešto dogodilo, da se anion vezao za kaliksaren vidjelo se već po promjeni boje – kompleks sa svakim anionom imao je drugu boju. No kako je tekao pokus sa CO2?

Kaliksaren CA-AZ ne veže ugljikov dioksid, no samo dok se ne prevede u fluoridni kompleks (CA-AZ-F-) te doda malo vode. Ako se to napravi, vlažni CA-AZ-F- će početi vezati ugljikov dioksid iz zraka već za 15 sekundi da bi nakon 44 sekundi reakcija praktički završila uz vezanje 68 % CO2 iz zraka. Da bi se reagens obnovio, treba preko njega tri minute propuštati dušik ili pak smanjiti tlak zraka. Nakon toga vlažna masa više ne sadrži ugljikov dioksid – to se vidi po promjeni boje iz žute u tamno plavu.
O primjeni novog sredstva za hvatanje CO2 još je rano govoriti. CA-AZ je mnogo skuplji od vapna, no vrlo se brzo i lako regenerira, pa bi se njegova upotreba unatoč višoj cijeni mogla isplatiti.

Nenad Raos je kemičar, znanstveni savjetnik u trajnome zvanju, koji je radio do umirovljenja 2016. godine u zagrebačkom Institutu za medicinska istraživanja i medicinu rada (IMI). Autor je i koautor oko 200 znanstvenih i stručnih radova iz područja teorijske (računalne) kemije, kemije kompleksnih spojeva, bioanorganske kemije i povijesti znanosti. Bio je pročelnik Sekcije za izobrazbu Hrvatskog kemijskog društva, glavni urednik Prirode te urednik rubrike Kemija u nastavi u časopisu Kemija u industriji. Još od studentskih dana bavi se popularizacijom znanosti. Uz mnoštvo znatsveno-popularnih članaka napisao je i 15 znanstveno-popularnih knjiga. Posljednja je "Kemičar u kući - kemija svakodnevnog života".















