Ugljične točke hvataju energiju Sunca
Jedan stari vic kaže da je moguće spojiti željezo sa celulozom jedino tako da se napravi čekić. No odnedavno je nešto takvo kemijski moguće – napraviti spoj grafita i celuloze.

Po čemu se razlikuju organski spojevi od anorganskih? Kemičar bi u 19. stoljeću rekao da se organski spojevi nalaze u živoj prirodi, da se dobivaju izolacijom iz biljnog i životinjskog tkiva, dok se anorganski spojevi nalaze u neživoj prirodi, u carstvu minerala („mineralne tvari“). No ta su vremena već dugo iza nas, naime od 1828. godine kada je mladi njemački kemičar Friedrich Wöhler dobio „živu“ tvar, mokraćevinu, (NH2)2CO, grijanjem „nežive tvari“, amonijava cijanata, NH4CNO. Otada se organska kemija u udžbenicima definira kao kemija ugljikovih spojeva – no krivo se (tako) definira!
Krivo se definira jer ima mnogo ugljikovih spojeva koji nisu „organski“, primjerice ugljikov monoksid, ugljikov dioksid i karbonati. (Zar su vapnenac i soda bikarbona organske tvari?) Mnogo se bolje organska kemija definira kao kemija karbogenih spojeva, dakle čistih tvari od kojih zagrijavanjem nastaje (genesis) ugljen (carbo). Drugim riječima, svaki se organski spoj može pretvoriti u ugljen, u ugljik, u grafit, nažalost ne i u dijamant, pri normalnom tlaku, razumije se. To se događa ako se zagrijava bez prisustva zraka na temperaturi od 400 – 600 oC. (Na tom se procesu, karbonizaciji, temelji proizvodnja drvenog ugljena, ali zbog nje – avaj – dobivamo garež na tavi.)
Pretvaranje organske tvari u ugljik vrlo je jednostavno, ali samo ako nam nije stalo kakav ćemo ugljik dobiti. No kemičarima je do toga i te kako stalo: „Constructing ultra-stable photothermal plastics assisted by carbon dots with photocaged reactivity“ – govori naslov znanstvenog rada kineskih znanstvenika objavljenog u časopisu Matter. Ključna riječ je „ugljična točka“ (carbon dot) zahvaljujući kojoj je napravljen izvanredno otporan (ultra-stable) plastični materijal koji izvrsno apsorbira Sunčevo zračenje (photothermal plastics).
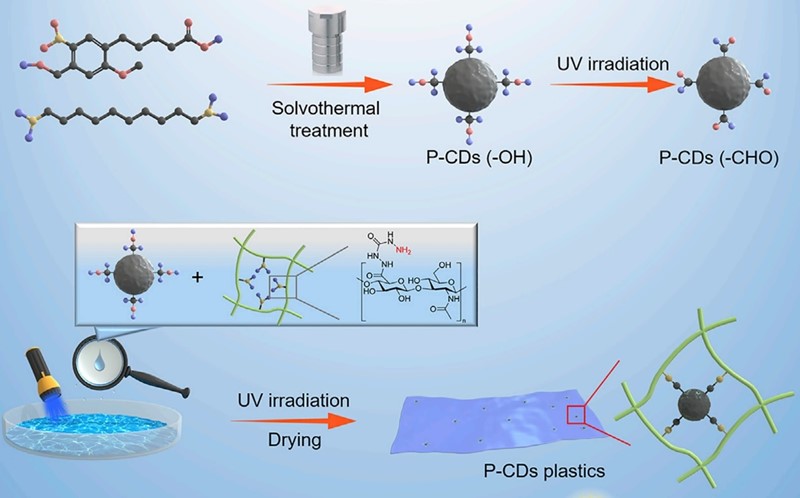
Sve počinje s ugljičnom točkom ili ugljičnim točkama (nanočesticama) koje apsorbiraju fotone (carbon dots with photocaged reactivity, P-CDs). One se rade tako da se dva organska spoja, 1,10-diaminodekan i 4-(4-(hidroksimetil)-2-metoksi-5-nitrofenoksi)butanska kiselina otope u alkoholu (etanolu) te potom griju osam sati pod tlakom na temperaturi od 180 oC. Pri takvim uvjetima od njih nastaje ugljik – ali kakav ugljik!
Nastaju čestice grafita velike samo 3,7 nm. No nije riječ samo o grafitu. Čestice sadrže i nešto dušika (2 %) te znatan udio kisika (23 %), pa se elementarnim sastavom približavaju sastavu ugljena. I dobro je da je tako. Jer kisik u njima nije nečistoća nego vrlo vrijedan sastojak. On se naime nalazi u obliku alkoholnih, hidroksilnih skupina, -OH, koje se potom djelovanjem kisika iz zraka i ultraljubičastog zračenja oksidiraju u aldehidne skupine, -CHO. Pomiješaju li se zatim ugljične čestice („točke“) s polimernim materijalom (derivatom celuloze s amino skupinama) doći će do kemijske reakcije (-CHO + H2N- → -CH=N- + H2O) uslijed koje će se čestice ugljika čvrsto, kovalentnim vezama, povezati s molekulama plastike. Zbog toga se „crnilo“ neće moći isprati iz materijala kao što se događa ako se čestice samo pomiješaju s plastikom.

Novi materijal izvrsno apsorbira Sunčevo zračenje u širokom rasponu valnih duljina (200 – 2600 nm), što znači da ne apsorbira samo svjetlost (λ = 480 – 780 nm), nego i infracrveno (λ < 380), a još više ultraljubičasto zračenje (λ > 780 nm). Posljedica toga je da P-CD-plastika pretvara gotovo polovicu (46,6 %) Sunčeva zračenja u toplinu, što je znatno bolje od drugih „crnih“ i organskih i anorganskih materijala. Usto se odlikuje velikom rasteznom čvrstoćom (150 MPa) i žilavošću (7,5 MJ/cm3).

Ne samo to! Ako se između P-CD-plastike i hladne površine postave poluvodički elementi, može se iz Sunčeve svjetlosti dobiti električna energija. Prednost takvog pretvaranja energije Sunca je što se uz elektricitet dobiva i toplina: ako se uređaj hladi vodom dobiva se topla voda.
U dostignuću kineskih znanstvenika nema ničeg fundamentalno novog, no u praktičnom smislu riječ je o velikom koraku prema boljoj upotrebi Sunca: on ide putem koji vodi prema jednostavnijim, lakšim, jeftinijim, a nadasve trajnijim uređajima za korištenje obnovljivih izvora energije.

Nenad Raos je kemičar, znanstveni savjetnik u trajnome zvanju, koji je radio do umirovljenja 2016. godine u zagrebačkom Institutu za medicinska istraživanja i medicinu rada (IMI). Autor je i koautor oko 200 znanstvenih i stručnih radova iz područja teorijske (računalne) kemije, kemije kompleksnih spojeva, bioanorganske kemije, povijesti kemije i komunikacijskih vještina u znanosti. Bio je pročelnik Sekcije za izobrazbu Hrvatskog kemijskog društva, glavni urednik Prirode te urednik rubrike Kemija u nastavi u časopisu Kemija u industriji; član je društva ProGeo-Hrvatska i Odjela za prirodoslovlje i matematiku Matice hrvatske. Još od studentskih dana bavi se popularizacijom znanosti. Autor je 15 znanstveno-popularnih knjiga, posljednje dvije su „Kemija – muza arhitekture“ (u koautorstvu sa Zvonkom Pađanom) i „Kemičar u kući – kemija svakodnevnog života“.















