Elektrolit od stakla – za natrijeve baterije
Natrijeva baterija bila bi jednostavna sprava da u njoj ne nastaju čestice natrija koje mrve elektrodu. Rješenje je u elektrolitu koji je i nije tekuć – u elektrolitu od stakla.

Ova, 2022. godina je svjetska godina stakla. (Ne čudim se što ne znate, i ja sam to tek nedavno saznao.) No, što je staklo? Staklo je prozirna tvar koja se dobiva staljivanjem kremenog pijeska (SiO2), sode (Na2CO3) i vapnenca (CaCO3) u staklarskoj peći. I jest i nije tako. Tako je jer se tako dobiva ono najčešće, prozorsko staklo. U masu za staklo može se dodati aluminijev i borov oksid (da bi se dobilo vatrostalno staklo), olovni oksid (za kristalno staklo) ili oksidi teških metala (kobalta, bakra, željeza, mangana, nikla, srebra...) da bi se proizvelo staklo u svim duginim bojama. To su sve silikatna stakla, no ima i stakla druge vrste.
Staklo je, ukratko, tvar osebujnih svojstava, neovisno o kemijskom sastavu. Neki kažu da je staklo amorfna krutina, drugi da je pothlađena tekućina, a treći – krijući svoje neznanje iza neodređene, pravo rečeno tautološke definicije – da je staklo ime za posebno agregatno stanje tvari. Ono što staklo čini posebnim je da u njemu – kao ni u tekućini – nema kristala, pa opet ne teče poput tekućine. Stoga se staklo može napraviti ne samo od silikata (prozorsko, vatrostalno, kristalno... staklo) nego i od mnogih drugih tvari, čak i od metala (metalno staklo).
Da bi upravo staklo moglo biti rješenje za električne baterije koje koriste prijenos elektrona između atoma natrija i atoma sumpora, stara je zamisao, no nikako da se ostvari. Pa ipak, ima nade. U radu kineskih znanstvenika „An electrochemically stable homogeneous glassy electrolyte formed at room temperature for all-solid-state sodium batteries“ objavljenom u časopisu Nature Communication, dano je rješenje problema ili barem put prema njegovom rješenju.
Stakla se dobivaju hlađenjem taline, pa i ono metalno – koje se dobiva tako brzim hlađenjem da se metal ne uspije iskristalizirati. Sa staklom kineskih znanstvenika nije tako. Ono je dobiveno dugim mljevenjem praha natrijeva sulfida, Na2S, s prahom fosforova sulifida, P2S5. Njihovom reakcijom nastaje staklo sastava Na3PS4 – na sobnoj temperaturi (formed at room temperature). Dobiveni se stakleni prah potom preša u pločice.
Ima jedan zgodan školski pokus u kojem se na staklenu cijev pričvrste elektrode, a onda se pusti električna struja. Struja ne teče sve dok se staklo ne zagrije plinskim plamenikom. Tako je to i kod ovog, tiofosfatnog stakla, no ono već pri temperaturi od 60 oC dostiže električnu vodljivost otopina soli.

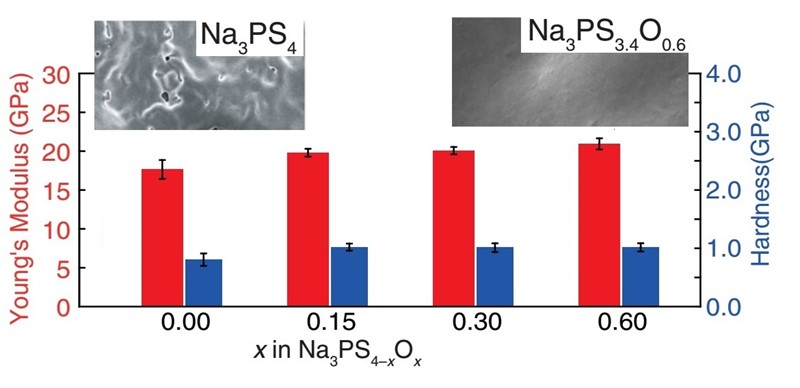
Druga prednost staklenog elektrolita je mehanička čvrstoća koja jamči da se nova baterija neće pri upotrebi slomiti ili iscuriti. Prednost su svakako jeftine sirovine i njihova bezopasnost za okoliš – jer stakleni se elektrolit lako reciklira, a ne sadrži druge kemijske elemente osim onih koji se normalno nalaze u živoj prirodi, pa i u ljudskom tijelu. No najveća prednost novog elektrolita, baš zato što je od stakla, je što natrij – koji nastaje pri punjenju baterije – ne uništava (ne mrvi) elektrodu nego se slobodno širi u stakleni, plastični elektrolit. Još su bolja mehanička svojstva fosforno-sumpornog stakla postignuta kada je smjesi natrijeva i fosforova sulfida dodan fosforov pentoksid, P2O5. Pritom su nastajala stakla sastava Na3PS4-xOx, s vrijednošću x od 0 do 0,60. Na kraju se pokazalo da se najbolji elektolit dobiva kombinacijom stakla s više (x = 0,60) i manje (x = 0,15) kisika – i evo baterije!

Najveća postignuti kapacitet baterije je 1280 Ah/kg uz visoko iskorištenje od 92 %. No takvo stanje nije trajno jer već nakon 40 ciklusa punjenja i pražnjenja kapacitet baterije pada na 1116 Ah/kg uz potencijal izbijanja 1,42 V. Pri gustoći struje od 0,1 mA/cm2 baterija može izdržati 150 ciklusa bez pada napona.
Kada se iz tih podataka izračuna specifična energija, dolazi se do vrijednosti od 5,7 MJ/kg ili 1,6 kWh/kg – što je već sada bolje od ponajboljih litij-ionskih baterija (> 0,5 kWh/kg). To bi bilo činjenice. A kada ćemo vidjeti takve baterije u našim autima ne bih znao reći – jer nisam vidovit.

Nenad Raos je kemičar, doktor prirodnih znanosti i znanstveni savjetnik u trajnome zvanju, sada u mirovini. Autor je i koautor više od stotinu znanstvenih i stručnih radova iz područja bioanorganske i teorijske kemije, molekularnog modeliranja te povijesti kemije i komunikacijskih vještina u znanosti. Još od studentskih dana bavi se popularizacijom znanosti. Sada piše za Čovjek i svemir te, naravno, Bug online. Sedam je godina bio glavni i tehnički urednik časopisa Priroda, a danas je glavni urednik mrežnih stranica Panopticum. Koautor je dva sveučilišna udžbenika i autor 13 znanstveno-popularnih knjiga. Nagrađen je Državnom godišnjom nagradom za promidžbu i popularizaciju znanosti 2003. godine.















